一、实验动物的采血实验动物的采血方法
实验研究中,经常要采集实验动物的血液进行常规质量检测、细胞学实验或进行生物化学分析,故必须掌握正确的采集血液的技术。采血方法的选择,主要决定于实验的目的和所需血量以及动物种类。
㈠大鼠、小鼠的采血方法
⒈剪尾采血
需血量很少时常用本法,如作红、白细胞计数、血红蛋白测定、制作血涂片等可与此法。动物麻醉后,将尾尖剪去约5mm,从尾部向尾尖部按摩,血即从断端流出。也可用刀割破尾动脉或尾静脉,让血液自行流出。如不麻醉,采血量较小。采血结束后,消毒、止
血。用此法每只鼠可采血10 余次。小鼠可每次采血约0.1ml,大鼠约0.4ml。
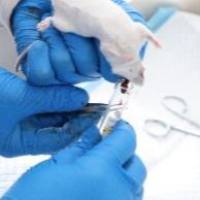
⒉眼眶后静脉丛采血
穿刺采用一根特制的长7~10cm硬的玻璃取血管,其一端内径为1 ~1.5mm,另一端逐渐扩大,细端长约1cm即可,将取血管浸入1%肝素溶液,干燥后使用。采血时,左手拇指及食指抓住鼠两耳之间的皮肤使鼠固定,并轻轻压迫颈部两侧,阻碍静脉回流,使眼球
充分外突,提示眼眶后静脉丛冲血。右手持取血管,将其尖端插入内眼角与眼球之间,轻轻向眼底方向刺入,当感到有阻力时即停止刺入,旋转取血管以切开静脉丛,血液即流入取血管中。采血结束后,拔出取血管,放松左手,出血即停止。用本法在短期内可重复采血。小鼠一次可采血0.2~0.3ml,大鼠一次可采血0.5~1.0ml。
⒊颈(股)静脉或颈(股)动脉采血
将鼠麻醉,剪去一侧颈部外侧被毛,作颈静脉或颈动脉分离手术,用注射器即可抽出所需血量。大鼠多采用股静脉或股动脉,方法是:大鼠经麻醉后,剪开腹股沟处皮肤,即可看到股静脉,把此静脉剪断或用注射器采血即可,股动脉较深需剥离出,再采血。
⒋摘眼球采血
此法常用于鼠类大量采血。采血时,用左手固定动物,压迫眼球,尽量使眼球突出,右手用镊子或止血钳迅速摘除眼球,眼眶内很快流出血液。
⒌断头采血
用剪子迅速剪掉动物头部,立即将动物颈朝下,提起动物,血液可流入已准备好的容器中。
㈡豚鼠采血方法
⒈耳缘切口采血
先将豚鼠耳消毒,用刀片沿血管方向割破耳缘,切口约长0.5cm,在切口边缘涂上20%的柠檬酸钠溶液,防治血凝,则血可自切口处流出。此法采血每次可采0.5ml。
⒉背中足静脉采血
固定豚鼠,将其右或左后肢膝关节伸直,脚背消毒,找出足静脉,左手拇指和食指拉住豚鼠的趾端,右手将注射针刺入静脉,拔针后立即出血。
⒊心脏采血
用手指触摸,选择心跳最明显的部位,把注射针刺入心脏,血液即流入针管。心脏采血时所用的针头应细长些,以免发生采血后穿刺孔出血。
㈢兔的采血方法
⒈耳缘静脉采血
将兔固定,拔去耳缘静脉局部的被毛,消毒,用手指轻弹兔耳,使静脉扩张,用针头刺耳缘静脉末端,或用刀片沿血管方向割破一小切口,血液即流出。本法为兔最常用的采血方法,可多次重复使用。
⒉耳中央动脉采血
在兔耳中央有一条较粗的、颜色较鲜红的中央动脉。用左手固定兔耳,右手持注射器,在中央动脉的末端,沿着与动脉平行的向心方向刺入动脉,即可见血液进入针管。由于兔耳中央动脉容易痉挛,故抽血前必须让兔耳充分充血,采血时动作要迅速。采血所用针头
不要太细,一般用6号针头,针刺部位从中央动脉末端开始,不要在近耳根部采血。
⒋心脏采血
使家兔仰卧,穿刺部位在第三肋间胸骨左缘3mm处, 针头刺入心脏后,持针手可感觉到兔心脏有节律的跳动。此时如还抽不到血,可以前后进退调节针头的位置,注意切不可使针头在胸腔内左右摆动,以防弄伤兔的心、肺。
㈣狗的采血方法
⒈后肢外侧小隐静脉采血:
后肢外侧小隐静脉位于后肢胫部下三分之一的外侧浅表皮下,由前侧方向后行走。采血时,将动物固定,局部剪毛、消毒,采血者左手紧握剪毛区上部或扎紧止血带,使下部静脉充血,右手用连有6 号或7 号针头的注射器刺入静脉,左手放松,已适当速度抽血即 可。
⒉前肢背侧皮下头静脉采血
前肢背侧皮下头静脉位于前脚爪的上方背侧的正前位。采血方法同上。
⒊颈静脉采血
前两种方法需技术熟练,且不适于连续采血。大量或连续采血时,可采用颈静脉采血,方法同小鼠、大鼠的颈静脉采血方法。
⒋股动脉采血
本法为采取动脉血最常用的方法。操作简便,稍加训练的狗,在清醒状态下将狗卧位固定于狗解剖台上。伸展后肢向外伸直,暴露腹股沟三角动脉搏动的部位,剪毛、消毒,左手中指、食指探模股动脉跳动部位,并固定好血管,右手取连有5 号半针头的注射器,针头由动脉跳动处直接刺入血管,若刺入动脉一般可见鲜红血液流入注射器,有时还需微微转动一下针头或上下移动一下针头,方见鲜红血液流入。有时可能刺入静脉,必须重抽。抽血毕,迅速拔出针头,用干药棉压迫止血2-3 分钟。三)颈静脉采血:前两种方法需技术熟练,且不适于连续采血。大量或连续采血时,可采用颈静脉采血,方法同小鼠、大鼠的颈静脉采血方法。
⒌股动脉采血
本法为采取动脉血最常用的方法。操作简便,稍加训练的狗,在清醒状态下将狗卧位固定于狗解剖台上。伸展后肢向外伸直,暴露腹股沟三角动脉搏动的部位,剪毛、消毒,左手中指、食指探模股动脉跳动部位,并固定好血管,右手取连有5 号半针头的注射器,针头由动脉跳动处直接刺入血管,若刺入动脉一般可见鲜红血液流入注射器,有时还需微微转动一下针头或上下移动一下针头,方见鲜红血液流入。有时可能刺入静脉,必须重抽。抽血毕,迅速拔出针头,用干药棉压迫止血2-3分钟。
二、 实验动物的处死
当实验中途停止或结束时,实验者应站在实验动物的立场上以人道的原则去处置动物,原则上不给实验动物任何恐怖和痛苦,也就是要施行安乐死。安乐死是指实验动物在没有痛苦感觉的情况下死去。实验动物安乐死方法的选择取决于动物的种类与研究的课题。
㈠蛙类
常用金属探针插入枕骨大孔,破坏脑脊髓的方法处死。将蛙用湿布包住,露出头部,左手执蛙,并用食指按压其头部前端,拇指按压背部,使头前俯;右手持探针由凹陷处垂直刺入,刺破皮肤即入枕骨大孔。
这时将探针尖端转向头方,向前深入颅腔,然后向各方搅动,以捣毁脑组织。再把探针由枕骨大孔刺入并转向尾方,刺入椎管,以破坏脊髓。脑和脊髓是否完全破坏,可检查动物四肢肌肉的紧张性是否完全消失。拔出探针后,用一小干棉球将针孔堵住,以防止出血。操作过程中要防止毒腺分泌物射入实验者眼内。如被射入时,则需立即用生理盐水冲洗眼睛。
㈡大鼠和小鼠
⒈ 颈椎脱臼法:右手抓住鼠尾用力向后拉,同时左手拇指与食指用力向下按住鼠头。将脊髓与脑髓拉断,鼠便立即死亡。
⒉ 断头法:用剪刀在鼠颈部将鼠头剪掉,鼠立即死亡。
⒊ 击打法:右手抓住鼠尾,提起,用力摔击其头部,鼠痉挛后立即死去。或用木锤用力击打鼠头部也可致死。
⒋急性大出血法:可采用鼠眼眶动脉和静脉急性大量失血方法使鼠立即死亡。
⒌药物致死法:吸入一定量的一氧化碳、乙醚、氯仿等均可使动物致死。
㈢狗、兔、豚鼠
⒈ 空气栓塞法
向动物静脉内注入一定量的空气,使之发生栓塞而死。当空气注入静脉后,可在右心随着心脏的跳动使空气与血液成泡沫状,随血液循环到全身。如进到肺动脉,可阻塞其分支,进入心脏冠状动脉,造成冠状动脉阻塞,发生严重的血液循环障碍,动物很快致死。一般兔、猫等静脉内注入20~40ml空气即可致死。每条狗由前肢或后肢皮下静脉注入80~150ml空气,可很快致死。
⒉ 急性失血法
先使动物轻度麻醉,如狗可按每公斤体重静脉注射硫喷妥钠20~30mg,动物即很快入睡。暴露股三角区,用锋利的杀狗刀在股三角区作一个约10 厘米的横切口,把股动、静脉全切断,立即喷出血液。
用一块湿纱布不断擦去股动脉切口周围处的血液和血凝块,同时不断的用自来水冲洗流血,使股动脉切口保持畅通,动物在3~5 分钟内即可致死。采用此种方法,动物十分安静,对脏器无损伤,对活杀采集病理切片标本是一种较好的方法。
如果处死狗的同时要采集其血液时,则在用硫喷妥钠轻度麻醉后,将狗固定在狗手术台上。分离颈动脉,插一根较粗的塑料管,放低狗头,打开动脉夹,使动脉血流入装有抗凝血的容器内,并不断摇晃,以防血液凝固。