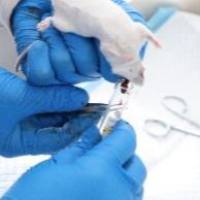
实验动物的给药途径及取血方法
互联网
一、实验动物的用药途径及方法
动物给药的途径和方法可根据动物种类、实验目的和药物而定,常用的方法简介如下。
(一)经口给药
有口服与灌胃两种方法。口服法可将药物放入饲料或溶于饮水中,使动物自行摄取。为保证剂量准确,应使用灌胃法,适用于小白鼠、大白鼠及家兔等动物。
1. 小鼠、大鼠(或豚鼠)灌胃时将灌胃针安在注射器上,吸入药液。左手抓住鼠背部及颈部皮肤将动物固定,右手持注射器,将灌胃针插入动物口中,用灌胃针管压其上腭,使口腔和食道成一条直线,再沿咽后壁徐徐插入食管。针插入时应无阻力。若感到阻力或动物挣扎时,应拔出重插,以免损伤或穿破食管以及误入气管。
一般当灌胃针插入小鼠3~4cm,大鼠或豚鼠4~6cm后可将药物注入。常用的灌胃量小鼠为0.2~1ml,大鼠1~4ml,豚鼠为1~5ml。
2. 猴、狗、猫、兔 灌胃时,先将动物固定,用特制的扩口器放入动物口中,并用绳将它固定于嘴部。将带有弹性的橡皮导管(如导尿管),经扩口器上的小圆孔插入,沿咽后壁而进入食管。此时应检查导管是否插入食管,可将导管外口置于一盛水的烧杯中,如不发生气泡,即认为此导管是在食管中,即可将药液灌入。灌胃完毕后,先拔出导尿管,再取下张口器。
各种动物一次灌胃能耐受的最大容积根据体重大小而不同:小鼠为0.5~1.0ml,大鼠为3~7ml,豚鼠为4~6ml,家兔为80~150ml,狗为200~500ml。
(二)注射给药
1. 皮下注射 皮下注射给药是将药液推入皮下结缔组织,经毛细血管、淋巴管吸收进入血液循环的过程。注射时,常规消毒注射部位皮肤,用左手拇指和食指提起皮肤,注射针头取一钝角角度刺入皮下,将针头轻轻向左右摆动,易摆动则表示已刺入皮下,再轻轻抽吸,如无回血,可缓慢地将药物注入皮下。
拔针时左手拇、食指捏住进针部位片刻,以防止药物外漏。皮下注射部位一般大白鼠在侧下腹部;豚鼠在后大腿内侧或小腹部;兔在背部或耳根部注射;狗、猫多在大腿外侧;蛙可在脊背部淋巴腔注射。
2. 皮内注射 是将药液注入皮肤的表皮与真皮之间。此法可用于观察皮肤血管的通透性变化或皮内反应,多用于接种、过敏实验等。操作时须将注射的局部脱去被毛,常规消毒后,用左手拇指和食指按住皮肤并使之绷紧,在两指之间,用注射器连4号小针头,紧贴皮肤表层刺入皮内,然后再向上挑起并再稍刺入,即可注射药液,皮肤表面此时可见一白色小皮丘。
3. 肌肉注射 一般多选用臀部或股部肌肉发达、无大血管通过的部位,注射时将针头迅速刺入肌肉,回抽无回血,即可进行注射。给大白鼠、小白鼠等小动物作肌肉注射时,用左手抓住鼠两耳和头部皮肤,右手取连有5号针头的注射器,将针头刺入大腿外侧肌肉,将药液注入。
4. 腹腔注射 常用于大鼠或小鼠给药。用左手捕捉固定动物,使腹部向上,鼠头略低于尾部,右手将注射针头自下腹部靠近腹白线的两侧刺入皮下,使针头向前推0.5~ 1.0cm,再以45°角穿过腹肌,缓缓注入药液。为避免伤及内脏,可使动物处于头低位,使内脏移向上腹。若实验动物为家兔,进针部位为下腹部的腹白线离开1cm处。
5. 静脉注射
(1)狗:狗静脉注射多选用前肢内侧头静脉或后肢小隐静脉,注射前应先剪去注射部位的被毛,用胶带扎紧静脉近心端,使血管充盈,针尖自远心端刺入血管,有回血后,固定针头,徐徐注入药液。
(2)家兔:一般选用外侧耳缘静脉。注射前应先拔去注射部位的被毛,用手指轻弹或轻揉兔耳,左手食指与中指夹住静脉的近心端,阻止静脉回流,使静脉充盈,用拇指和无名指固定耳缘静脉远心端,右手持针尽量从远端刺入,回抽有回血后用左手拇指固定针头,放开食指和中指,将药液注入。
(3)小鼠和大鼠:一般采用尾静脉注射,鼠尾静脉有3根,两侧及背侧各一根,左右两侧尾静脉较易固定,应优先选择。注射前先将动物固定在鼠筒或玻璃罩内,使鼠尾露出,在45℃~50℃热水中浸泡,或用酒精擦拭,使血管扩张。
用拇指和食指捏住尾根部,再以无名指和小指夹住尾端部,用中指从下托起尾巴固定,右手持注射器连4号细针头,从尾下1/4处进针,如针确已在静脉内,则注药无阻,否则局部发白隆起,应拔出针头再移向前方静脉部位重新穿刺。
(4)蛙类:将蛙脑脊髓破坏后仰卧位固定于蛙板上,沿腹中线稍左剪开腹肌翻转,可见腹静脉紧贴腹壁肌肉下行,将针刺入即可。
6. 淋巴囊注射 蛙类皮下有数个淋巴囊,是蛙的给药常用途径,注射时应从口腔底部刺入肌层,再进入胸皮下淋巴囊注药,抽针后药液才不易流出。
此外,根据实验内容的不同还可采取呼吸道给药、皮肤给药、脊髓腔内给药、小脑延髓池给药、直肠内给药、关节腔内给药。
二、实验动物的取血方法
(一)大鼠、小鼠
1. 尾部取血 可采用针刺尾静脉和剪尾尖两种方法。
(1)针刺尾静脉:先固定动物,用酒精棉球消毒尾部,然后对准尾尖部向上数厘米处的静脉用注射针刺入后立即拔出。采血后用局部压迫、烧烙等方法进行止血。
(2)剪尾尖:将动物固定或麻醉后,露出鼠尾,将尾巴置于45℃~50℃热水中浸泡数分钟,使血管扩张。擦干鼠尾后,将尾尖剪去1~2mm(小鼠)或5mm(大鼠)。从尾根部向尾尖部按摩,血即从断端流出。
2. 眼部取血 可采用眼球后静脉丛取血法。用7号针头连接1ml的注射器或10ml长玻璃管(一端烧制拉成直径1~1.5mm的毛细管)。取血时左手抓住鼠两耳之间的皮肤使头固定,轻轻压迫颈部两侧,阻碍头部静脉回流,使眼球充分外突,球后静脉丛充血。
右手持注射器或玻管,将其插入内眦部,向眼底方向旋转插入。插入深度:小鼠为2~3mm,大鼠为4~5mm。因血压关系,血液自行流入管内,拔出针头或玻管,放松左手。为防止穿刺孔出血,可用纱布压迫眼球,达到止血目的。数分钟后可在同一穿刺孔重复取血。小鼠一次可采得血0.2ml,大鼠0.5ml。
3. 大血管取血 可采用颈动(静)脉、股动(静)脉、腹主动脉等方法取血。在这些部位取血均须麻醉后固定动物,然后作动(静)脉分离手术,使其充分暴露,用注射器沿大血管平行方向刺入,抽取所需血量。或直接用剪刀剪断大血管吸取,但切断动脉时,要防止血液喷溅。
4. 心脏取血 先将动物仰卧固定,左手食指在左侧第3~4肋间触到心尖搏动最强处,右手用连有针头的注射器在此穿刺。由于心脏跳动血液进入注射器。小鼠约0.5~0.6ml,大鼠约0.8~1.2ml。
5. 断头取血 这需要二人配合操作,采血者用左手将大(小)鼠的头颈部握紧,右手抓住躯干和后肢,将颈部暴露。助手用剪刀将鼠颈剪断(用力要大),采血者应迅速将大(小)鼠倒置,让血滴入容器。此方法用于实验结束后血液采集量大时。
(二)豚鼠
1. 耳缘剪口采血 将耳消毒后,用锐器割破耳缘,在切口边缘涂抹20%枸橼酸钠溶液,阻止血凝,则血可自切口自动流出,进入盛器。操作时,使耳充血效果较好。此法能采血0.5ml左右。
2. 心脏采血 取血前应探明心脏搏动最强部位,通常在胸骨左缘的正中,选心跳最明显的部位作穿刺。针头宜稍细长些,以免发生手术后穿刺孔出血。因豚鼠身体较小,一般可不必将动物固定在解剖台上,而可由助手握住前后肢进行采血。成年豚鼠采血应不超过10ml为宜。
3. 股动脉采血 将动物仰位固定在手术台上,减去腹股沟区的毛,麻醉后局部用碘酒消毒。切开长约2~3cm的皮肤,使股动脉暴露及分离,然后用镊子提起股动脉,远端结扎,近端用止血钳夹住,在动脉中央剪一小孔,用无菌玻璃小导管或聚乙烯、聚四氟乙烯管插入,放开止血钳,血液既由导管流出。一次可采血10~20ml。
4. 背中足静脉取血 固定动物,将其右或左后关节伸直,将动物脚背面用酒精消毒,找出背中足静脉后,一手拉住豚鼠的趾端,一手用注射器刺入静脉。拔针后立即出血,呈半球状隆起。采取后应压迫止血。
(三)家兔
1. 耳部取血 可采用耳缘静脉或耳中央动脉取血。首先拔去血管表面皮肤的毛,轻揉兔耳或用酒精涂抹皮肤使血管扩张。用注射器可从耳中央动脉抽取数毫升血。也可用针头刺破耳缘静脉末梢取血。
2. 大血管取血 可采用颈静脉、股静脉和后肢小隐静脉取血。
(1)颈静脉和股静脉取血:首先麻醉做血管分离术。然后用注射器沿血管方向刺入抽取血液。
(2)后肢小隐静脉取血:首先使动物仰卧然后固定,在小腿上端扎橡皮管,小腿外侧皮下可见充盈的静脉,经皮穿刺可以取血。
3. 心脏取血 在第三肋间胸骨左缘3mm心脏搏动最强处,将针头垂直刺入心脏,血即进入注射器。一次可取血20~25ml。
(四)狗和猫
1. 耳缘静脉取血 采血量较少时可用此法。用针头刺破静脉采血或直接用空针抽取。
2. 前、后肢静脉取血 前肢选用内侧皮下头静脉,位于前肢前部,在下1/3处向内侧走行;后肢选用外侧的隐静脉,位于跗关节外侧,距跗关节上方5~10cm处的皮下,由前斜向后上方走行。采血时,先将狗固定,用止血带扎住穿刺部位的上方,使静脉充盈。操作者手持注射器采血。
3. 颈静脉取血 此方法可取较多的血。先将狗麻醉固定,固定时将颈部尽量后仰,助手用手压住颈静脉入胸部的皮肤,使静脉怒张。操作者用左手绷紧进针部位的皮肤,右手拿注射器沿血管向心端刺入。采血后应注意止血。
还可从狗的心脏或股动、静脉采血。但技术要求较高,不容易成功,除非有特殊要求,否则可选用以上三种方法。
猫的取血方法与狗基本相似,可采用前肢皮下头静脉、后肢股静脉、耳缘静脉取血。采血量较大时,可从颈静脉抽取。