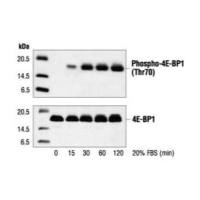
蛋白质印迹法中为什么检测不到目的蛋白?
CST
很多小伙伴在对胶片印迹进行短暂曝光后,检测不到目的蛋白。可从以下几个方面来优化实验步骤:
1、裂解物制备
每道全细胞提取物的 20–30 µg 总蛋白,通常足够用来检测。如果靶标蛋白的基础水平,或蛋白质修饰程度低,可能需要通过化学刺激剂来诱导表达或修饰。你可能要调查备选细胞系或组织,其所含的目的蛋白含量更高。应将样品溶解于适当的缓冲液中,该缓冲液包含蛋白酶抑制剂和针对磷酸化目标的磷酸酶抑制剂。应务必对裂解物进行超声处理,以确保有效的染色质和膜结合靶标的蛋白质提取。请查看我们网站上的对照物表,获得推荐的阳性对照物和处理方法。
2、一抗稀释和/或孵育
使用推荐的封闭剂(5% BSA 或 5% 脱脂奶粉),以推荐的稀释度溶解于 TBST 中,在 4°C 下,过夜孵育一抗。使用备选封闭剂,如明胶、血清、无蛋白封闭剂、酪蛋白、或混合封闭剂,可能降低靶标信号强度。如需单个抗体的优化结果,请查询产品数据表找到推荐的稀释缓冲液。
3、SDS-PAGE 凝胶选择
一般来说,推荐采用 Tris-Glycine 凝胶。但是,对于高分子量蛋白质,我们推荐采用 Tris-Acetate 凝胶和相关缓冲液。蛋白质从 1 毫米凝胶转移比从 1.5 毫米凝胶转移更有效。使用更厚的凝胶,可能会导致高分子量蛋白质的转移不完全,所以我们推荐监测转移效率,根据目的靶标蛋白质分子量大小,优化转移条件。
4、转移和膜
可通过延长转移时间或使用更高的电压,可改善转膜不完全。一般来说,我们建议在转移缓冲液中加入 20% 甲醇,然后在 70 V 电压下进行为时 2 小时的湿转。对于高分子量蛋白质,我们建议减少转移缓冲液中的甲醇至 5%,以提高转移效率并避免大分子蛋白质在凝胶基质中固定,并且在 70 V 电压下延长转移时间至 3 小时。检测较小的蛋白质时,可能在转膜期间出现过度转移(过膜蛋白质转移)问题。对于小蛋白质分子,使用孔隙大小为 0.2 µm 的膜并在 70 V 电压下进行为时 1.5 小时的湿转,而不是使用孔隙大小为 0.45 µm 的膜或进行过夜转移,这样做很重要,因为后者可能会导致过度转移和丢失小蛋白质分子信号。
5、封闭
膜封闭时间过长可能会掩盖抗原表位,并阻止抗体结合。在室温下仅封闭 1 小时。
6、洗涤
洗涤时间超过推荐的三次 5 分钟是一个常见问题,可能会导致减少信号。我们推荐计时洗涤,以确保准确性。TBST 应包含 0.1% Tween® 20。这适用于一抗和二抗孵育后的洗涤步骤。此外,我们建议在 TBST 中洗涤,因为已有数据显示在 PBST 中洗涤会导致减少信号。
7、二抗稀释和/或孵育
可用相同的细胞提取物和一抗在印迹上进行二抗的梯度稀释,以优化二抗浓度。务必在室温下,在含 5% 脱脂奶粉的 TBST 中孵育二抗 1 小时。避免在 HRP-偶联二抗的缓冲液中加入叠氮化钠,因为叠氮化物会抑制 HRP 的活性。
8、检测试剂
采用能用抗-生物素-HRP 进行检测的生物素化分子量标准作为化学发光检测的阳性对照物。