CYP450 酶代谢表型研究原理及实验方法
1 概述
1.1 药物代谢研究简介
药物代谢研究是创新药物研发的重要内容,它不仅决定了创新药物制剂研发的成败,而且与创新药物研发的速度和质量有密切关系。因而,药物代谢研究在新药研发工程中具有不可或缺的重要作用,研究药物代谢对于了解药物在体内的变化过程至关重要。
药物代谢研究的方法主要分为体内和体外两种。体内代谢法因药物在生物体内的分布较广,加上代谢转化的器官和酶系的多样性,使药物及其代谢产物在体内的浓度比较低,代谢产物的检测具有一定的困难。体外代谢法在短时间内可以得到大量的代谢产物,且代谢条件可控,代谢体系比较「干净」,代谢物易于分离、提取,有利于代谢途径研究及代谢产物结果的确定等,因而,体外代谢法具有突出的优越性。
由于肝脏是药物代谢的主要场所,体外代谢模型多以肝脏为基础。目前,研究体外代谢方法主要有:肝微粒体体外温孵法、重组 P450 酶体外温孵法、肝细胞体外温孵法、肝脏离体灌流法和肝切片法。其中,肝微粒体体外温孵法与其他体外代谢方法相比,酶制备简单,代谢过程快,重现性好,易大量操作,同时可用于药物代谢酶的抑制及体外清除等方面的研究,因而在实际工作中应用较为普遍。
1.2 CYP450 酶代谢表型研究的意义
为获得更好的治疗效果,联合用药在临床治疗中已非常普遍。然而,在获得更好的疗效的同时,常伴随着由药物-药物相互作用(drug-drug interaction,DDI)引起的不良反应事件的发生。如特非那丁与酮康唑合用时,酮康唑可显著地抑制特非那丁的代谢,造成特非那丁的血药浓度显著升高,可以导致致命的室间心律失常。因此,在新药临床前研究中,对药物的代谢酶表型进行鉴定,获得其主要代谢酶的消除比例,阐明参与药物体内代谢转化的相关酶亚型,对于研究药物的代谢机制,预测药物代谢多态性和药物间相互作用等方面具有重要意义。
药物代谢酶表型鉴定,主要是研究参与药物清除的代谢酶的类型、数量和相对贡献率。如果药物主要通过单一的代谢途径对药物进行清除,可能会存在很大的用药风险;相反,如果某一药物的代谢过程涉及的代谢酶越多,则说明其代谢途径也越多,也就难以发生潜在的药物-药物相互作用,使得患者之间的治疗偏差降低。
北京汇智泰康生物技术有限公司针对 CYP450 酶代谢表型研究的需要,以肝微粒体体外温孵法为指导,以化学抑制法为基础,开发了一款专门用于 CYP450 酶代谢表型研究的试剂盒,该产品可直接用于药物 CYP450 酶代谢表型研究,省去了肝微粒体制备和试剂配制的繁琐过程,大大缩短了实验周期,且试剂盒各组成成分经过严格的质量检测,符合 CYP450 酶代谢表型研究试验要求,实验结果准确、可靠、重现性好。
图 1 为采用肝微粒体技术研究西尼地平与几种临床常用药物间的代谢相互作用的实例,结果表明环孢素、红霉素和辛伐他丁在体外表现出对西尼地平代谢的抑制作用,由于三者均是 CYP3A 的抑制剂或底物,这提示西尼地平与 CYP3A 的抑制剂或底物合用时可能会出现代谢上的相互作用,使西尼地平的代谢速率降低,西尼地平二氢吡啶环脱氢代谢物生成减少,而原型药物的水平显著提高,这可能会影响临床疗效的正常发挥。
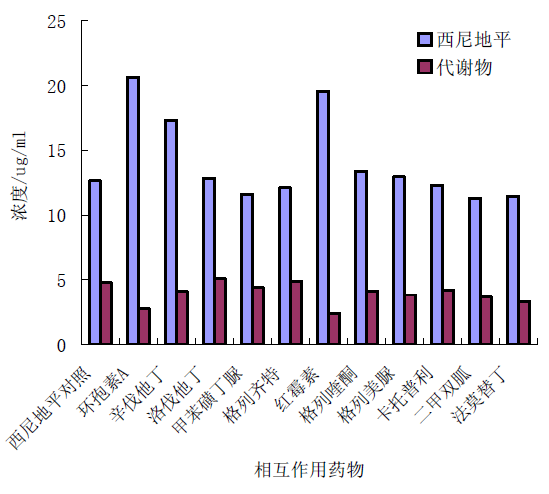
图 1 人肝微粒体中几种临床常用药物对西尼地平代谢的影响
如果合用的药物具有潜在的抑制或诱导代谢酶的能力,则前者将受到合用药物的影响,从而使其代谢清除途径发生量化的改变,这种药物相互作用可能会影响治疗效果,增加药物的治疗失败率,甚至诱发不良反应。因此,通过对代谢酶表型的体外研究来判定该化合物的主要代谢酶亚型,已成为药物临床前代谢研究工作中必不可少的一部分。
1.3 CYP450 酶及代谢表型研究方法
CYP450 为一类含亚铁血红素蛋白的超家族,根据相关酶亚型在药物代谢中的重要程度,可将 CYP450 分为以下三类:(1)主要 CYP450,包括 CYP1A2、CYP2C9 、CYP2C19 、CYP2D6 和 CYP3A4;(2)较主要 CYP450,包括 CYP2B6、CYP2C8 和 CYP3A5;(3)次要 CYP450,包括 CYP1A1、CYP1B1、CYP2A6、CYP2E1、CYP2J2 和 CYP4A11 等。参与药物代谢的动物肝微粒体 P450 酶较为复杂,而人肝微粒体中参与药物代谢的 P450 酶相对比较简单,主要有 CYP1A、CYP2C、CYP2D、CYP2E 和 CYP3A,其组成见图 2。
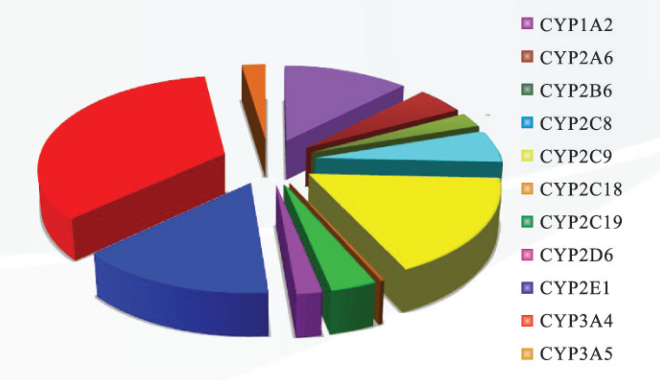
图 2 人肝内 P450 酶的组成
目前,CYP450 的酶表型鉴定主要使用以下 3 种方法:选择性抑制法、重组人源 CYP450 同工酶法、相关性分析法。选择性抑制法又分为化学抑制法和抗体抑制法,即在加入和不加入一系类 CYP450 酶亚型选择性化学抑制剂或抗体的条件下,分别测定人肝微粒体对药物的代谢活性,以考察人肝微粒体中 CYP450 酶亚型倍选择性抑制后,药物的代谢是否受到影响,从而计算相对抑制百分率,推断 CYP450 酶代谢表型。其中,化学抑制法由于其操作简单,且价格低廉而得到广泛应用。
2 实验原理
参与药物代谢的 CYP450 酶主要为 CYP1、CYP2 和 CYP3 三个家族,共有 7 种重要的亚型,分别为 CYP1A2、CYP2A6、CYP2C9、CYP2C19、CYP2D6、CYP2E1 和 CYP3A4;
α-奈黄酮为 CYP1A2 的特异的选择性抑制剂,毛果芸香碱为 CYP2A6 的特异的选择性抑制剂,噻氯匹定为 CYP2C19 的特异的选择性抑制剂,奎尼丁为 CYP2D6 的特异的选择性抑制剂,二乙基二硫代氨基甲酸钠为 CYP2E1 的特异的选择性抑制剂,酮康唑为 CYP3A4 的特异的选择性抑制剂,磺胺苯吡唑为 CYP2C9 的特异的选择性抑制剂,如选用特异的选择性抑制剂抑制不同亚型的酶的活性,便可研究药物的 CYP450 酶代谢表型。
3 实验方法描述
肝微粒体体外温孵法是采用肝微粒体,辅以 NADPH 再生系统,在体外模拟生理环境条件进行代谢反应,经过一定时间的反应后,采用 HPLC、HPLC-MC 和 HPLC-MC/MC 测定温孵液中原型药物和其代谢产物,并对代谢产物进行初步的分析和鉴定的方法。
3.1 肝微粒体制备
P450 酶主要在肝脏中表达,肝脏中的 P450 酶在体外是以微粒体的形式存在的。微粒体是指在细胞匀浆和差速离心过程中获得的由破碎的内质网自我融合形成的近似球形的膜囊泡状结构,是异质性的集合体。它包含内质网膜和核糖体两种基本成分,在体外实验中具有蛋白质合成、蛋白质糖基化和脂类合成等内质网的基本功能。目前,制备肝微粒体常用的方法是差速离心法。具体制备流程见下图(图 3):

图 3 肝微粒体制备流程图
3.2 体外孵育体系的建立
CYP450 酶代谢表型研究的肝微粒体体外孵育体系,是由制备的肝微粒体辅以氧化还原型辅酶,再加入酶特异的选择性抑制剂,在模拟生理温度及生理环境的条件下进行生化反应的体系。
推荐使用的孵育体系为:每个孵育体系总体积为 200 µL,体系包括 0.1M PH 7.4 的磷酸缓冲液,汇智泰康 NADPH 发生系统(1 mM NADP,5 mM 的 6 -磷酸葡萄糖,1 U/mL 6 -磷酸葡萄糖脱氢酶,3.3 mM 的氯化镁);0.5 mg/mL 的肝微粒体蛋白;适量的选择性抑制剂;合适浓度的待测物,于 37°C 水浴孵育,每个样品平行 3 次,以不加选择性抑制剂组为对照。于预设的反应时间点,加入等体积预冷的乙腈终止反应。
3.3 原型药物或代谢产物的检测
采用 HPLC、HPLC-MC 和 HPLC-MC/MC 测定温孵液中原型药物或其代谢产物的浓度。
例:
下图(图 4、图 5、图 6)为研究某一候选药物的 CYP450 酶代谢表型的实验,该实验采用选择性化学抑制剂的方法分析了该药物在鼠、犬和人肝微粒体中的代谢情况,从而判断微粒体中哪些 CYP450 亚型是该药物的主要代谢酶。
数据计算:
用待测物的消除速率表示待测物在微粒体孵育体系中的代谢速率。
抑制率%=(1 - 加入抑制剂样品代谢速率/空白对照样品代谢速率)×100%
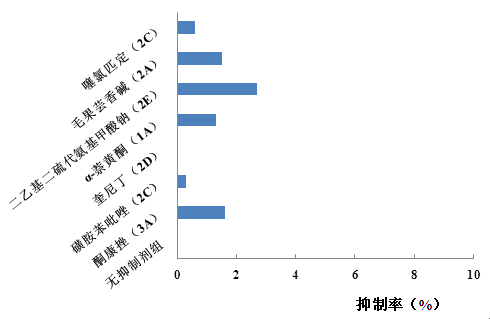
图 4 大鼠肝微粒中某药物的代谢抑制率
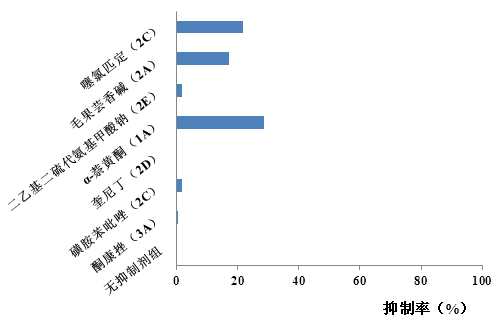
图 5 犬肝微粒中某药物的代谢抑制率
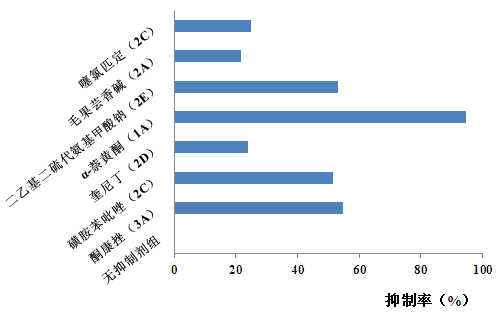
图 6 人肝微粒中某药物的代谢抑制率
从上图可知,不同种属微粒体中,该候选药物的代谢抑制率存在差异。表明,不同种属微粒体中参与该候选药物代谢的酶亚型可能不同。
4 本公司 CYP450 酶代谢表型研究试剂盒简介
北京汇智泰康生物技术有限公司针对 CYP450 酶代谢表型研究的需要,以肝微粒体体外温孵法为指导,以化学抑制法为基础,开发了一款专门用于 CYP450 酶代谢表型研究的试剂盒,该产品可直接用于药物 CYP450 酶代谢表型研究,省去了肝微粒体制备和试剂配制的繁琐过程,大大缩短了实验周期,且试剂盒各组成成分经过严格的质量检测,符合 CYP450 酶代谢表型研究试验要求,实验结果准确、可靠、重现性好。
4.1 产品说明
本产品提供了 CYP450 酶代谢表型研究用到的肝微粒体、NADPH 再生系统、酶特异性抑制剂及其它组分,可直接用于药物 CYP450 酶代谢表型研究。本产品可提供肝微粒体有:人肝微粒体、恒河猴肝微粒体、比格犬肝微粒体、大鼠肝微粒体和小鼠肝微粒体,可根据实际需求,选择不同种属的肝微粒体。
4.2 试剂盒优势
便捷——本试剂盒省去了肝微粒体制备和试剂配制时间,可以直接使用,大大缩短了实验周期。
准确——本试剂盒各成分均经过严格的质量检测,实验结果准确、可靠、重现性高。
稳定——本试剂盒稳定性强、易于运输和保存。
4.3 产品组成
50 反应/盒,200 μL/反应。
产品名称 | 规格 | 数量 |
A 液(20×) | 600 μL /支 | 1 支 |
B 液(100×) | 120 μL /支 | 1 支 |
肝微粒体(20 mg/mL) | 300 μL/支 | 1 支 |
阳性底物(200×) | 50 μL/支 | 1 支 |
选择性抑制剂 | 60 μL /支 | 7 支 |
0.1M PBS 缓冲液 | 10 mL/瓶 | 1 瓶 |
4.4 产品使用说明
本产品需于 -70 ℃ 冰箱冷冻保存,切记避免反复冻融。试验具体操作如下:
4.4.1 试验组
1)冰浴融化试剂盒各组分,置于冰上待用;
2)除微粒体外,将孵育体系其它各组分按照配比混合并吹吸混匀,于 37 ℃ 预孵育 5 min;
例:200 μL 孵育体系配制:
名称 | 加入量(μL) |
A 液 (20×) | 10 |
B 液 (100×) | 2 |
肝微粒体(20 mg/mL) | 5 |
选择性抑制剂 | 1 |
受试物(200×) | 1 |
0.1M PBS 缓冲液 | 181 |
注:
a. 体系中有机溶剂加入量不得大于 1%。
b. 若实际需要 n 个孵育体系,则需配置 n+1 个体系。
3)将以上混合液 195 μL/管分装至 1.5 mL 离心管中,于 37 ℃ 水浴中保温, 5 μL/反应加入肝微粒体,吹吸 3 次混匀于 37 ℃ 水浴条件下启动代谢反应,使用秒表计时;
4)于设定孵育时间点,向孵育体系中加入 200 μL 预冷的乙腈终止反应(预冷乙腈:孵育体系体积 = 1:1)。
4.4.2 对照组
1)加阳性底物组:反应体系中不加选择性抑制剂,并将受试物换为阳性底物,其它组分加入量不变,缺少体积用 0.1M PBS 缓冲液补齐;
2)无抑制剂组:反应体系中不加选择性抑制剂,其它组分加入量不变,缺少体积用 0.1M PBS 缓冲液补齐;
3)无 A 液、B 液组:反应体系中不加 A 液和 B 液,其它组分加入量不变,缺少体积用 0.1M PBS 缓冲液补齐。
4.4.3 结果判定
CYP450 酶亚型与选择性抑制剂对应一览表。
CYP450 酶亚型 | 选择性抑制剂 |
CYP1A2 | α-奈黄酮 |
CYP2A6 | 毛果芸香碱 |
CYP2C19 | 噻氯匹定 |
CYP2D6 | 奎尼丁 |
CYP2E1 | 二乙基二硫代氨基甲酸钠 |
CYP3A4 | 酮康唑 |
CYP2C9 | 磺胺苯吡唑 |
4.5 运输条件
干冰运输。
4.6 注意事项
1. 试验开始前,请自行准备 1.5 mL 离心管、不同规格枪头、乙腈、37℃ 水浴锅等。
2. 本产品仅供科研使用,不能用于人体及动物的治疗或临床诊断。
3. 使用前,需于冰浴条件下解冻并混合均匀。
4. 于 -70 ℃ 冰箱冷冻保存,切勿反复冻融。
5. 在使用过程中,也可根据实际实验需求调整各组分的加入量。