分子筛,你今天保养了吗
Cytiva(思拓凡)
10481
分子筛(SEC)无疑是众多层析方法中最娇贵的存在。要想获得满意的实验结果,一个高分辨高性能的柱子是必不可少的。刚接触层析的小伙伴们,接过这娇贵的柱子,是否不觉有种心跳加速,无从下手的感觉?这么娇贵的柱子,要怎么维护?不用担心,让我们一起了解学习一下吧~
首次使用建议:
在连接层析柱前,请务必务必务必确认流路中没有空气!一般柱子都是保存在20%乙醇溶液中,以避免微生物的繁殖,但是20%乙醇的粘度高于水溶液,因此,需要降低流速以避免柱床被压缩。
总结一下:
将柱子连接至系统,并确保连接时柱子前端的流路中没有气泡;
使用缓冲液置换柱子内的酒精时,请使用低流速;
如果需要,请测试柱子的耐压参数(increase系列);
刚才我们也提到了柱效测定,这是一个什么参数?我们应该怎么做呢?
测柱效是一个快速检测柱子与仪器性能的方法。或许你会问,我们一直在说柱子,为什么会提到了仪器?其实仪器管道的粗细、死体积的大小都会对柱效的结果有所影响,因此,评价一根柱子性能的变化,需要在相同的仪器相同的实验条件下进行。一般我们可以采用1%体积的1%丙酮在280nm吸收检测,具体的操作在每根柱子的说明书中有详细的介绍。另外ÄKTA仪器也能通过峰积分快速计算得到结果。
实验过程中,哪些地方需要我们关注的呢?
1. 低温下操作:为了保护蛋白的稳定性,很多小伙伴们都会选择在低温下进行层析。那么必须提醒一下,溶液在低温时,粘稠度会增加,所以一定要降低流速。除此之外,还需要注意的是,请确保所有溶液与柱子的温度保持一致,以避免因为温度的改变而引入气泡。
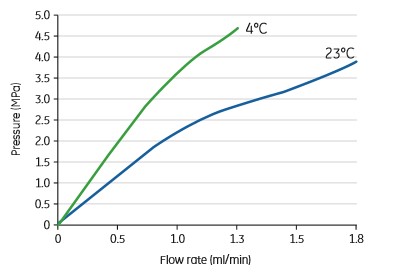
2. 样品制备:好的样品是实验成功的第一步。对于分子筛,所有的样品必须通过0.22μm滤膜过滤(或者10,000g离心10分钟取上清)避免颗粒物堵塞柱子。另外,需要确保实验过程中,pH、温度等条件下,样品不会变性或聚集沉淀。如果需要使用助溶的试剂(例如去污剂),请确保实验过程中的样品、溶液中同时添加。
3. 缓冲溶液:分子筛属于非吸附式层析,只需要一种缓冲溶液,具有非常好的兼容性,基本上我们只需要考虑蛋白的稳定性来选择合适的缓冲液。一般我们在实验中会加入150-300mM的NaCl,以降低非特异的吸附。使用不同的溶液的时候,因为溶液本身粘稠度的不同,请适当降低流速以保护柱子。

4. 常规清洗:定期的清洗能够延长柱子的使用寿命,维持好的分辨率。清洗的频率与样品和对分辨率的要求等实际情况相关。通常,如果发现柱子顶端有颜色的改变,或者柱子的背压增高,分辨率下降等,那就提示我们需要及时对柱子进行清洗了。对于Superdex和Superose系列的柱子,一般都建议反向的清洗,Hiprep Sephacryl系列柱子则一般采用正向清洗。最常规的清洗方式是采用1个柱体积的0.5M NaOH(Superdex 和Superose系列)或者0.2M NaOH(Sephacryl系列),并马上用2个柱体积的水和2个柱体积的缓冲液平衡,切勿长时间的将柱子保存在NaOH溶液中。
如果常规清洗仍无法达到理想的效果,可以根据残留物的不同选择其它的清洗方式:例如:0.5M 醋酸溶液,1M NaOH,8M尿素或者6M 盐酸胍(针对蛋白沉淀),30%异丙醇(对于脂类或者疏水物质),再者还可以考虑使用胃蛋白酶(1mg/ml溶于0.1M醋酸、0.5MNaCl中)消化,再使用NaOH清洗。
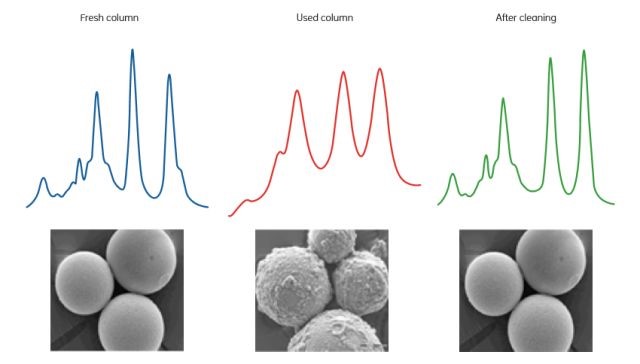
5. 保存:如果超过2天不使用层析柱,建议使用2倍柱体积的水冲洗柱子后再使用2倍柱体积的20%乙醇冲洗柱子保存。(Hiload Superdex 30pg与Hiload Superdex 75pg建议在20%乙醇中加入0.2M NaAc,以保持pH的稳定)。再次强调,20%乙醇的粘度比较高,请注意降低流速。如果长期保存或者需要运输,请链接保护装置以避免因为环境的改变而引入的气泡。
其实,分子筛的使用并不复杂,只要胆大心细,认真耐心,一定能获得好的实验结果~
首次使用建议:
在连接层析柱前,请务必务必务必确认流路中没有空气!一般柱子都是保存在20%乙醇溶液中,以避免微生物的繁殖,但是20%乙醇的粘度高于水溶液,因此,需要降低流速以避免柱床被压缩。
总结一下:
将柱子连接至系统,并确保连接时柱子前端的流路中没有气泡;
您的层析柱已经准备就绪。
刚才我们也提到了柱效测定,这是一个什么参数?我们应该怎么做呢?
测柱效是一个快速检测柱子与仪器性能的方法。或许你会问,我们一直在说柱子,为什么会提到了仪器?其实仪器管道的粗细、死体积的大小都会对柱效的结果有所影响,因此,评价一根柱子性能的变化,需要在相同的仪器相同的实验条件下进行。一般我们可以采用1%体积的1%丙酮在280nm吸收检测,具体的操作在每根柱子的说明书中有详细的介绍。另外ÄKTA仪器也能通过峰积分快速计算得到结果。
实验过程中,哪些地方需要我们关注的呢?
1. 低温下操作:为了保护蛋白的稳定性,很多小伙伴们都会选择在低温下进行层析。那么必须提醒一下,溶液在低温时,粘稠度会增加,所以一定要降低流速。除此之外,还需要注意的是,请确保所有溶液与柱子的温度保持一致,以避免因为温度的改变而引入气泡。

2. 样品制备:好的样品是实验成功的第一步。对于分子筛,所有的样品必须通过0.22μm滤膜过滤(或者10,000g离心10分钟取上清)避免颗粒物堵塞柱子。另外,需要确保实验过程中,pH、温度等条件下,样品不会变性或聚集沉淀。如果需要使用助溶的试剂(例如去污剂),请确保实验过程中的样品、溶液中同时添加。
3. 缓冲溶液:分子筛属于非吸附式层析,只需要一种缓冲溶液,具有非常好的兼容性,基本上我们只需要考虑蛋白的稳定性来选择合适的缓冲液。一般我们在实验中会加入150-300mM的NaCl,以降低非特异的吸附。使用不同的溶液的时候,因为溶液本身粘稠度的不同,请适当降低流速以保护柱子。

4. 常规清洗:定期的清洗能够延长柱子的使用寿命,维持好的分辨率。清洗的频率与样品和对分辨率的要求等实际情况相关。通常,如果发现柱子顶端有颜色的改变,或者柱子的背压增高,分辨率下降等,那就提示我们需要及时对柱子进行清洗了。对于Superdex和Superose系列的柱子,一般都建议反向的清洗,Hiprep Sephacryl系列柱子则一般采用正向清洗。最常规的清洗方式是采用1个柱体积的0.5M NaOH(Superdex 和Superose系列)或者0.2M NaOH(Sephacryl系列),并马上用2个柱体积的水和2个柱体积的缓冲液平衡,切勿长时间的将柱子保存在NaOH溶液中。
如果常规清洗仍无法达到理想的效果,可以根据残留物的不同选择其它的清洗方式:例如:0.5M 醋酸溶液,1M NaOH,8M尿素或者6M 盐酸胍(针对蛋白沉淀),30%异丙醇(对于脂类或者疏水物质),再者还可以考虑使用胃蛋白酶(1mg/ml溶于0.1M醋酸、0.5MNaCl中)消化,再使用NaOH清洗。

5. 保存:如果超过2天不使用层析柱,建议使用2倍柱体积的水冲洗柱子后再使用2倍柱体积的20%乙醇冲洗柱子保存。(Hiload Superdex 30pg与Hiload Superdex 75pg建议在20%乙醇中加入0.2M NaAc,以保持pH的稳定)。再次强调,20%乙醇的粘度比较高,请注意降低流速。如果长期保存或者需要运输,请链接保护装置以避免因为环境的改变而引入的气泡。
其实,分子筛的使用并不复杂,只要胆大心细,认真耐心,一定能获得好的实验结果~