MCD饲料诱导大/小鼠NASH模型的对比研究
江苏省协同医药生物工程有限公司
非酒精脂肪性肝炎(NASH)是一种无过量饮酒,以肝脏细胞脂肪变性、气球样变、弥散性肝小叶炎症为主要临床病理特征的综合征。它是非酒精脂肪性肝病(NAFLD)发展为肝硬化和肝癌的一个重要阶段。据报道 NAFLD 在发达国家的发病率表现为成人 30%、儿童 13%,其中大约有 10% 的 NAFLD 患者发展成为 NASH,而 NASH 患者中的 10% 会发展成为肝硬化,甚至肝癌。

非酒精脂肪性肝炎已经成为研究的焦点,然而 NASH 的发病机制尚未明确,研究发现其与胰岛素抵抗、氧化应激、瘦素、Kupffer 细胞等多种因素相关。目前临床上的药物普遍存在毒副作用较大、价格昂贵等问题,而被证实的有效且无副作用治疗方法仅有适当的渐进性减肥运动这一项。 因此探索新型无毒副作用药物对其 NASH 临床治疗具有重要意义,而可靠的动物模型对探索 NASH 的发病机制及防治发挥着关键性作用。
目前国内外的NASH模型主要包括3类:
① 营养失调性脂肪肝动物模型,它包括了高脂饮食脂肪肝动物模型、高糖饮食脂肪肝动物模型和蛋氨酸胆碱缺乏(MCD)脂肪肝动物模型。
② 复合因素诱导的 NASH 模型,主要是以高脂肪饲料加化学药物来进行造模,包括四氯化碳脂肪肝动物模型、四环素脂肪肝动物模型、乙硫氨酸脂肪肝动物模型。
③ 特殊品系脂肪肝动物模型,主要有瘦素缺乏和抵抗小鼠模型、 PTEN 基因敲除小鼠模型。其中, MCD 饲料诱导的 NASH 模型是目前国际上被广泛认可的模型。
该模型最早由 Shinozuka 提出,起初是用于探讨饮食因素对肝脏肿瘤形成的影响,后来发现在短期内可以引起脂肪性肝炎。该模型的脂肪性肝炎发展速度快,其病理病变与人类的 NASH 类似,因此成为近年来国内外学者研究 NASH 的热点模型,但未见关于在大小鼠体内用 MCD 饲料诱导 NASH 模型差异比较的报道。
本研究旨在通过 MCD 饲料分别建立大、小鼠 NASH 模型,比较其生化和病理指标,探讨两种动物模型的差异,为 NASH 的基础研究和防治药物的开发提供可靠的动物模型。
实验动物与方案
实验动物
SPF 级 C57BL/6 雄性小鼠 18 只,8~9 周龄,体重为 22~25 g;SPF 级 SD 雄性大鼠 18 只,8~9 周龄,体重为 300~350g。饲养于遵义医学院实验动物中心,屏障环境动物房室温(22 ±1)° ,相对湿度 30%~60%,12h 光照 /12h 黑暗,动物自由采食和饮水。
实验试剂
检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和胆固醇(TC)含量的试剂盒,均购自德国罗氏诊断公司,按说明书和文献报道的方法进行检测。
动物饲料
蛋氨酸胆碱缺乏(MCD)饲料和蛋氨酸胆碱充足(MCS)饲料,根据饲料生产公司技术人员的指导进行饲养。
动物分组
将 18 只 C57BL/6 小鼠和 18 只 SD 大鼠分别随机分成正常组(饲喂 MCS 饲料)和模型组(饲喂 MCD 饲料)。模型组需要 1 周过渡性饲料的喂养,第 1 ~3 天将 MCS 和 MCD 饲料按 2:1 混合后喂养,第 4 ~5 天按 1:1 混合喂养,第 6-7 天按 1:2 混合喂养,1 周后完全投喂 MCD 饲料。过渡性饲养后的第 3、5、8 周在各组中分别随机选取 6 只动物样本,进行肝功能生化指标和肝脏病理的检测。从过渡饲喂开始且每周称量动物体质量(g)并记录。
实验结果
体质量变化
正常对照组实验动物的体质量持续增长,模型组实验动物体质量逐渐减轻;从第 3周开始,相比于正常组,模型组的实验动物体质量都显著降低。

动物血清中 ALT、AST、TC 和 TG 的含量
从第 3 周开始,模型组小鼠肝酶 AST 和 ALT 水平与正常组相比,均已显著升高。相比之下,大鼠模型组在检测的 3 个时间点,肝酶 AST 水平无显著变化,而 ALT 水平从第 3 周开始显著升高。在检测的造模后第 3 周、5 周、8 周,大、小鼠血清中 TG 和 TC 含量均显著降低。
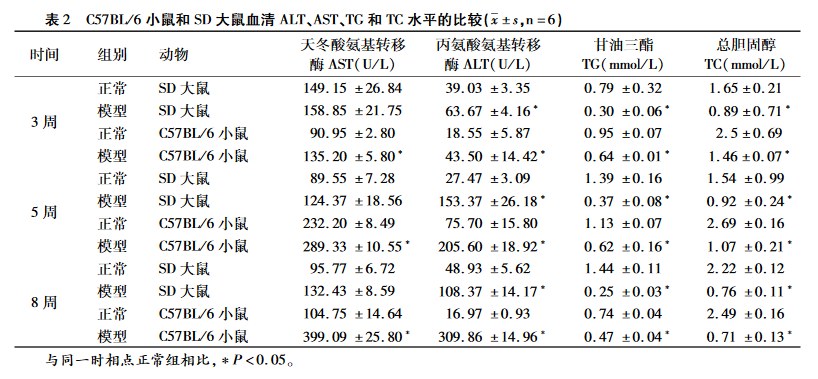
肝组织 HE 染色
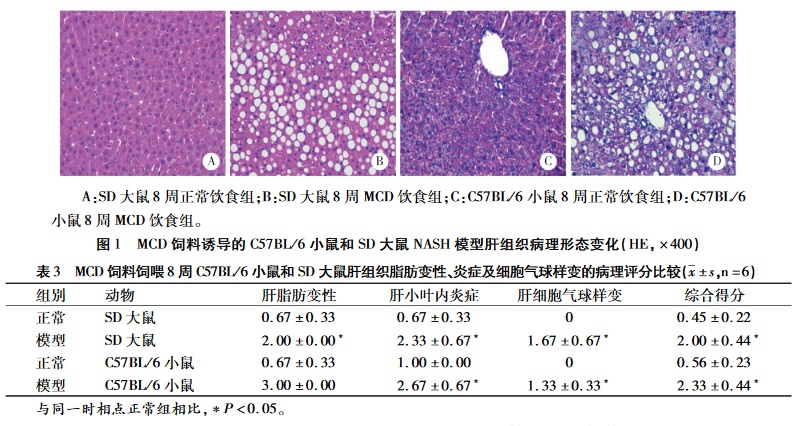
正常对照组肝小叶结构清晰、完整,肝细胞以中央静脉为中心,呈放射状排 列 , 无肝细胞气球样变或炎症细胞浸润(见图 1A、C)。MCD 饲料饲喂 8 周后,模型组的大鼠肝组织小叶结构已被破坏,大泡性气球样变细胞占了总细胞的 2/3 以上,以肝小叶周边脂肪变性最为严重, 局部可见大泡性气球样变和以单个核细胞浸润为主炎症反应(见图 1B)。8 周时模型组小鼠肝组织光镜下见肝小叶结构紊乱,细胞出现严重的脂肪变 性,中央静脉周围出现严重、以浸润为主的局灶坏 死性炎症(见图 1D)。具体 NAFLD 活动度积分见表 3,SD 大鼠和 C57BL/6 小鼠综合评分均表现为模型组与正常组之间差异具有统计学意义(P< 0. 05)。
实验讨论
MCD 饲料诱导的 NASH 模型的主要发病机制是由于饲料缺乏胆碱而引起机体卵磷脂合成不足。蛋氨酸为合成载脂蛋白所必需的氨基酸,缺乏 酸会导致低密度脂蛋白胆固醇合成减少,因此无法 将三酰甘油运出肝外而累积形成脂肪肝。另一方面,缺乏胆碱还会引起肝脏线粒体内部活性氧增加,最终导致氧应激增加而肝脏发生损伤。氧应激不但导致细胞多种功能和结构损伤,而且活化 TNFα及其他促炎症细胞因子。
该模型自 1978 年 Shinozuka 提出以来,被国内外的学者广泛应用于药物筛选,但是缺少文献对该模型在 C57BL/6 小鼠和 SD 大鼠的系统性报道。于是本实验饲喂 MCD 饲料建立大、小鼠 NASH 模型,对其血液的生化指标和肝脏的病理指标进行了比较,旨在探讨两种动物模型的生化和病理差异,以选择理想的动物模型。
本研究的结果显示,在肝损伤指数方面,饲喂 MCD 饲料的第 3 周开始,模型组小鼠的肝酶 AST、 ALT 水平与正常组相比已经显著升高,但模型大鼠 AST 水平从实验开始至结束仍无显著差异,而 AST 和 ALT 的水平在临床研究中通常作为肝脏功能评价重要指标,反映脂肪肝的早期损害,因此表明 C57BL/6 小鼠对 MCD 饲料的反应在早期比 SD 大鼠更敏感 ,更容易引起肝损伤肝 。
而且肝组织病理结果显示,饲喂 MCD 饲料 8 周,模型组小鼠肝组织比大鼠出现的脂肪变性更严重,小区域出现小泡为主的细胞气球样变及轻微的炎症反应;同时通过肝组织病例评分结果表明 8 周后模型组小鼠肝组织炎症反应及脂肪变性等病理特征的得分明显高于大鼠。另外,小鼠具有采食量少、成本低及操作方便等优点。因此,综合生化指标及病理特征等因素,MCD 饲料诱导的 C57BL/6 小鼠模型比 SD 大鼠模型更适用于进一步研究 NASH。

![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)






