单细胞测序在肝癌炎癌转化机制中的研究思路
上海烈冰生物医药科技有限公司
2182
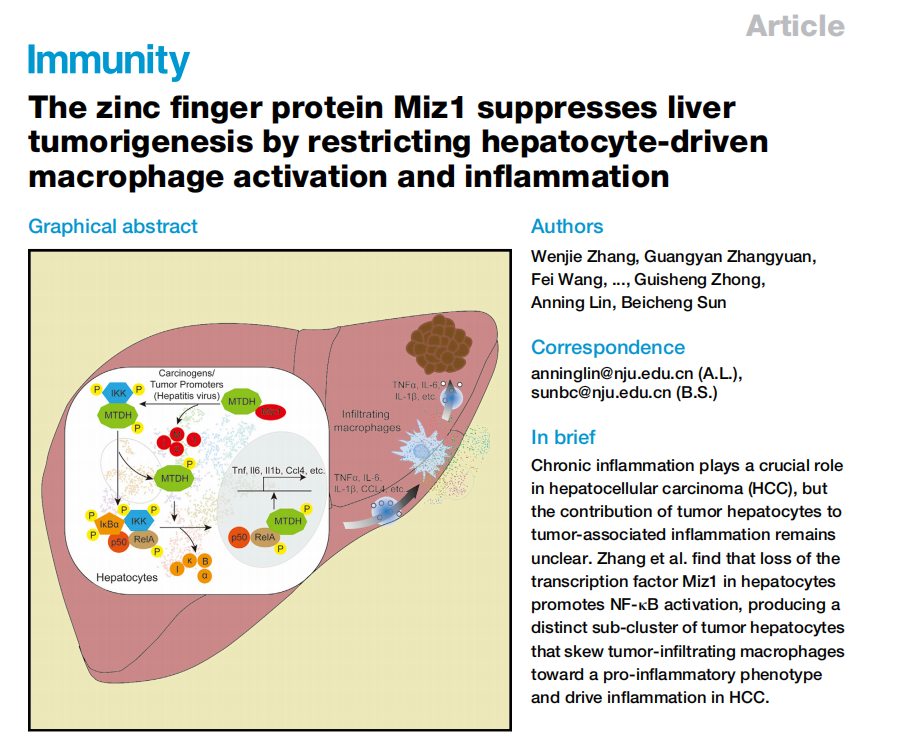
肝细胞癌(HCC)是全球癌症相关死亡的第三大原因。多种病理因素,如HBV和HCV感染、饮酒、致癌基因DNA损伤和肥胖,均能够诱导炎性肿瘤微环境,进而促进肝癌的发生发展。国际免疫学顶级期刊Immunity于北京时间2021年5月25日晚23时在线发表应用单细胞测序探究肝癌转化调控机制的最新成果——“The zinc finger protein Miz1 suppresses liver tumorigenesis by restricting hepatocyte-driven macrophage activation and inflammation。
样本信息
除WT(untreated)外,其它组小鼠(雄性)均出生后两周开始注射DEN,后期每周注射CCl4以诱导肝癌的发生。
分选平台:10X Genomics
单细胞实验分组:Miz1∆hep:Miz1F/F=2:2
捕获细胞数:
总细胞数24802个(Miz1∆hep:13753个,Miz1F/F:11049个),
其中,肝细胞2365个(9.5% total cell,Miz1∆hep:1343个,Miz1F/F:1022个);
巨噬细胞4277个(17.2% total cell,Miz1∆hep:2934个,Miz1F/F:1343个)
技术手段:
磁共振成像(MRI)
HE染色
免疫荧光
免疫组化
免疫印迹分析
单细胞转录组测序
FACS分选验证
分析工具应用:
t-SNE分析
细胞类型鉴定
细胞类型细分鉴定
差异基因表达分析
Pseudo-time分析
Qusage分析
细胞通讯分析
结果解析
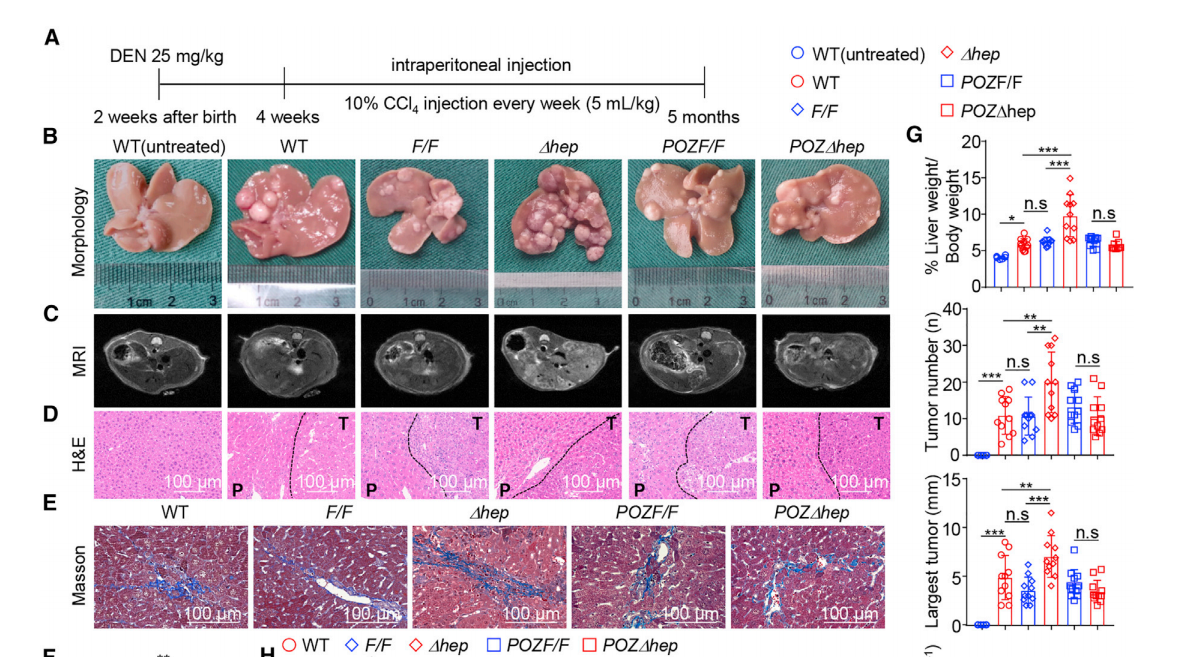
1. Miz1缺失促进肝细胞增殖和HCC敏感性
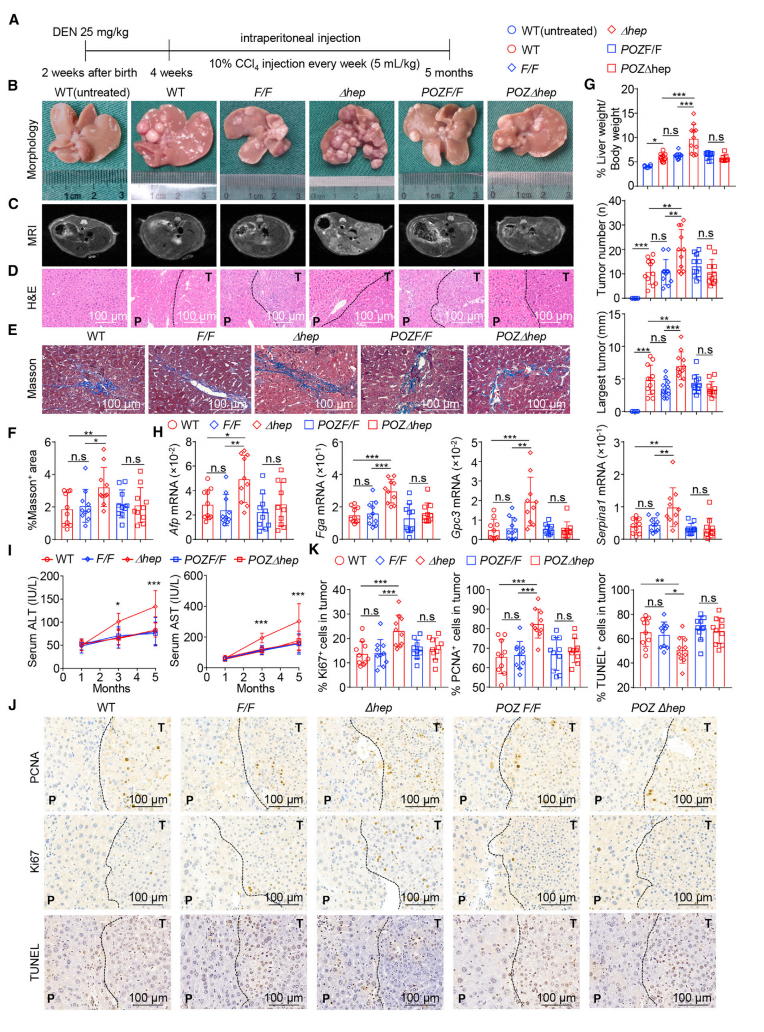
研究者在DEN/CCl4诱导肝癌的小鼠模型中,通过核磁共振,HE染色成像和相关数据统计,发现Miz1∆hep小鼠的肝损伤并不是晚期肿瘤诱导的结果,但肝细胞转录因子Miz1的缺失促进了肝细胞的增殖和细胞凋亡减少,同时,Miz1∆hep小鼠对化学物质或炎症相关的HCC的敏感性增加。
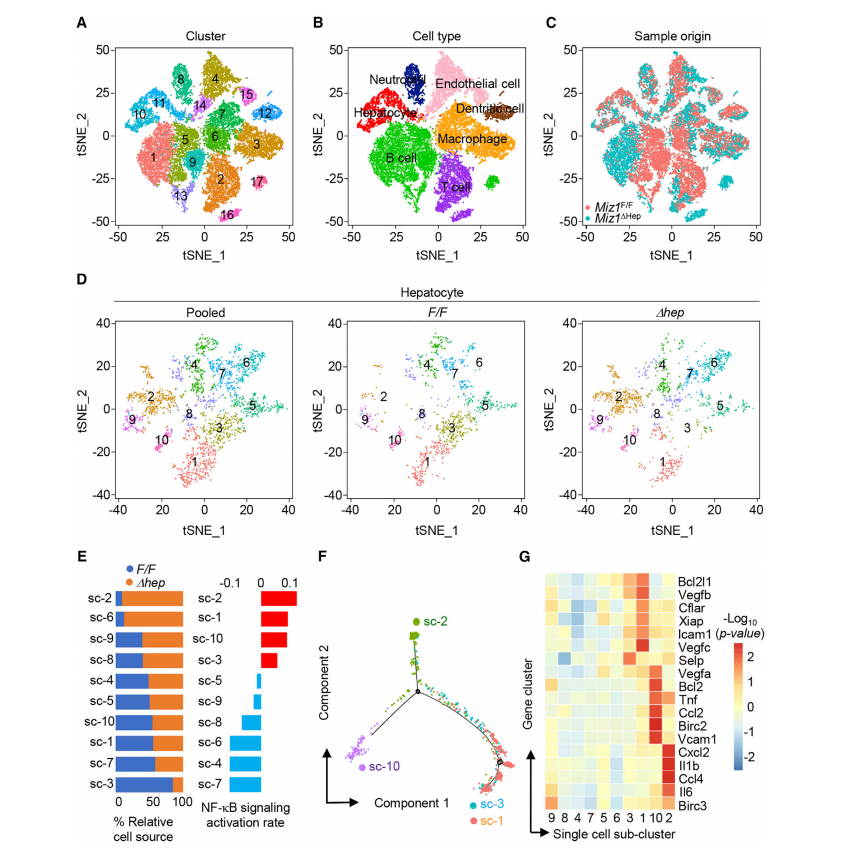
2. Miz1缺失促进核因子(NF-κB)激活
接着,研究者对Miz1F/F和Miz1∆hep两组小鼠样本进行了单细胞测序,共获得24,802个细胞,注释细胞类型主要包括肝实质细胞(2365个,9.5% total cell),中性粒细胞,内皮细胞,树突状细胞,B 细胞,T细胞和巨噬细胞(4277个,17.2% total cell)。对肝细胞群体进一步进行subCluster,拟时序分析,差异基因表达分析发现,Miz1∆hep小鼠产生了独特的肿瘤肝细胞群体,该群细胞高度表达NF-κB下游的细胞因子和驱化因子。
进一步,研究者通过免疫印迹和免疫组化分析证实,肝细胞 Miz1 的缺失促进IKK介导的MTDH的磷酸化,从而促进了 NF-κB 的激活和 NF-κB 下游炎症相关靶基因的表达。
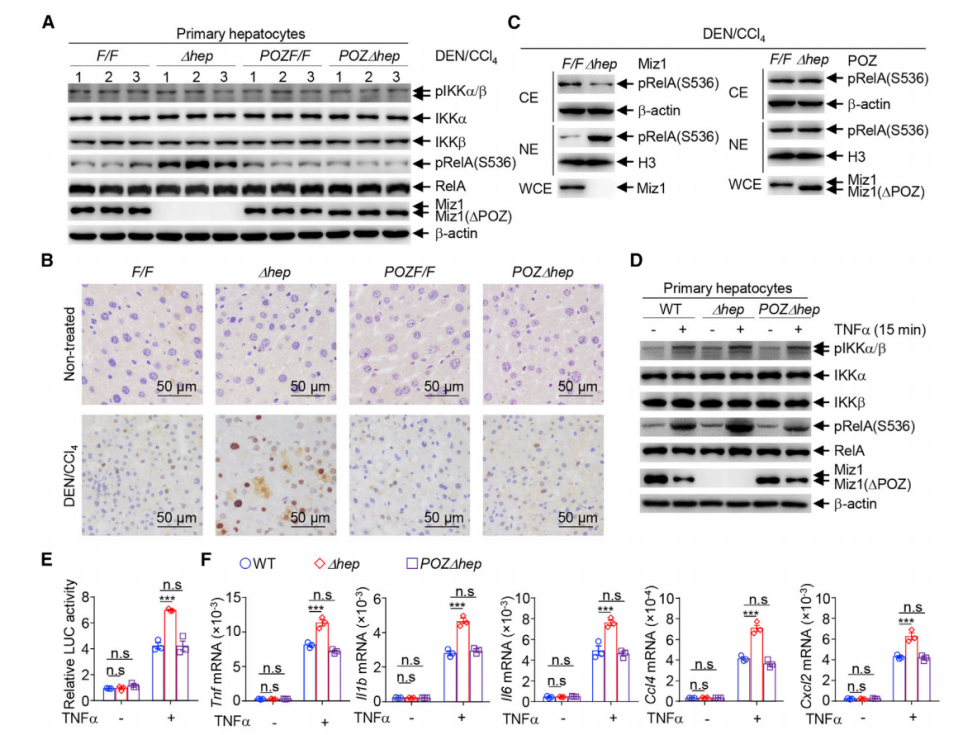
3. 肿瘤特有肝细胞分泌细胞因子促进肿瘤浸润巨噬细胞向促炎表型转化
对巨噬细胞亚群和肝脏特有巨噬细胞(Kupffer cell)进一步细分,并进行差异基因分析和Qusage分析,发现Miz1∆hep小鼠的肿瘤浸润巨噬细胞和 Kupffer 细胞的一些亚群NF-κB 强烈激活,肿瘤浸润巨噬细胞向促炎表型转化。

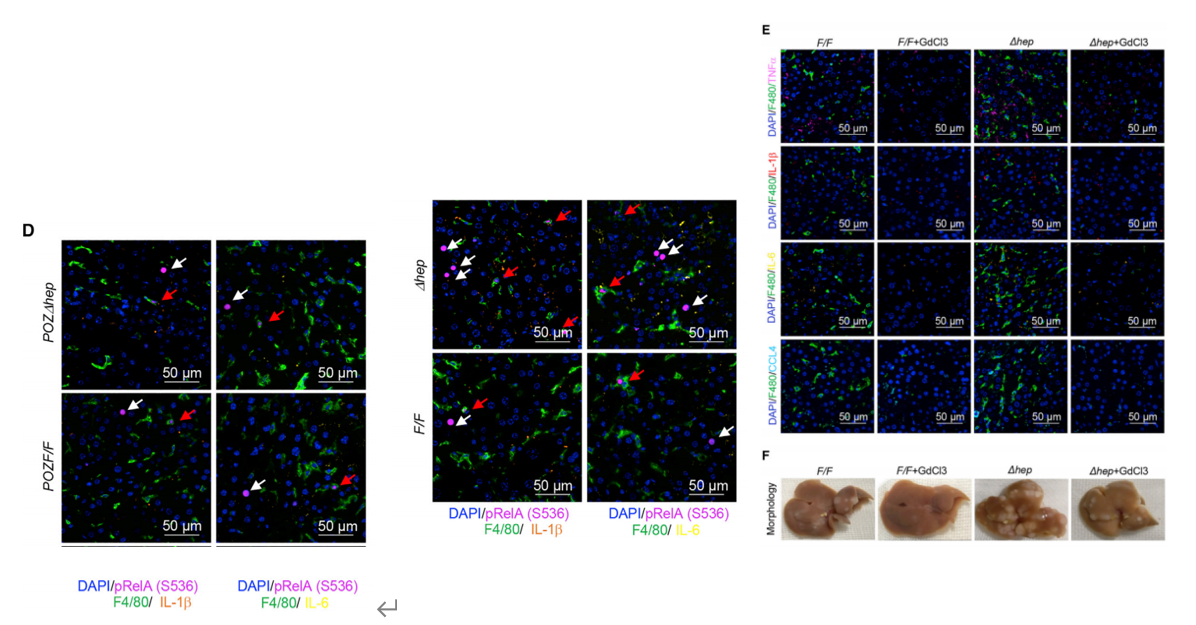
究其原因,研究者发现,肿瘤特有的肝细胞能促进炎性细胞因子分泌(TNF-α,IL-1β, IL-6等)和相关基因表达,驱动肿瘤浸润的巨噬细胞向促炎表型倾斜,巨噬细胞受其驱动,IL-1β, IL-6的基因表达上调,促炎性细胞因子增加并驱动了HCC中的炎症。对炎性巨噬细胞消除处理(GdCl3)后,小鼠肝脏/体重比、最大肿瘤直径有所恢复。
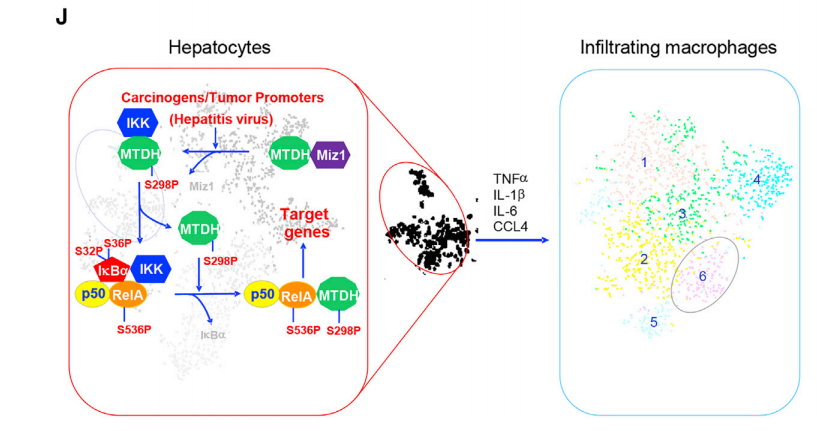
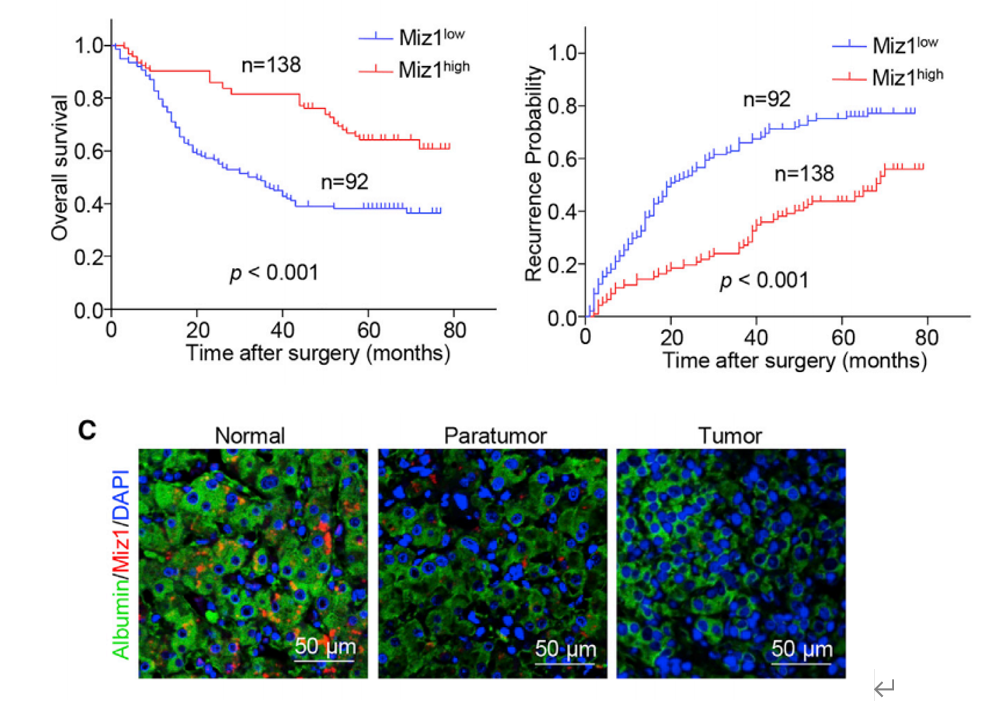
Miz1抑制肿瘤发生机制在于:1.Miz1与RelA竞争结合癌蛋白MTDH。2.抑制IKK酶活性降低MTDH磷酸化。相关临床试验也证实了Miz1在不同HCC患者中的表达与肝细胞RelA和MTDH的磷酸化呈反相关,与HCC患者复发和整体预后也密切相关。
总的来说,本研究基于单细胞测序和其它组学分析,结合多种体内、体外实验,发现小鼠肝细胞中转录因子Miz1缺失,产生了高表达NF-κB下游炎症因子的特异性“炎性”肝细胞亚群,激活肿瘤浸润巨噬细胞向促炎表型转化,增强肝脏炎症反应,促进肝癌的发生发展。

样本信息
除WT(untreated)外,其它组小鼠(雄性)均出生后两周开始注射DEN,后期每周注射CCl4以诱导肝癌的发生。
分选平台:10X Genomics
单细胞实验分组:Miz1∆hep:Miz1F/F=2:2
捕获细胞数:
总细胞数24802个(Miz1∆hep:13753个,Miz1F/F:11049个),
其中,肝细胞2365个(9.5% total cell,Miz1∆hep:1343个,Miz1F/F:1022个);
巨噬细胞4277个(17.2% total cell,Miz1∆hep:2934个,Miz1F/F:1343个)

| 实验分组 | Miz1处理 | POZ处理 | 不敲除基因 |
| 对照组 | Miz1F/F | POZF/F | WT(untreated) |
| 实验组 | Miz1∆hep | POZ∆hep | WT |
技术手段:
磁共振成像(MRI)
HE染色
免疫荧光
免疫组化
免疫印迹分析
单细胞转录组测序
FACS分选验证
分析工具应用:
t-SNE分析
细胞类型鉴定
细胞类型细分鉴定
差异基因表达分析
Pseudo-time分析
Qusage分析
细胞通讯分析
结果解析
1. Miz1缺失促进肝细胞增殖和HCC敏感性
研究者在DEN/CCl4诱导肝癌的小鼠模型中,通过核磁共振,HE染色成像和相关数据统计,发现Miz1∆hep小鼠的肝损伤并不是晚期肿瘤诱导的结果,但肝细胞转录因子Miz1的缺失促进了肝细胞的增殖和细胞凋亡减少,同时,Miz1∆hep小鼠对化学物质或炎症相关的HCC的敏感性增加。

2. Miz1缺失促进核因子(NF-κB)激活
接着,研究者对Miz1F/F和Miz1∆hep两组小鼠样本进行了单细胞测序,共获得24,802个细胞,注释细胞类型主要包括肝实质细胞(2365个,9.5% total cell),中性粒细胞,内皮细胞,树突状细胞,B 细胞,T细胞和巨噬细胞(4277个,17.2% total cell)。对肝细胞群体进一步进行subCluster,拟时序分析,差异基因表达分析发现,Miz1∆hep小鼠产生了独特的肿瘤肝细胞群体,该群细胞高度表达NF-κB下游的细胞因子和驱化因子。

进一步,研究者通过免疫印迹和免疫组化分析证实,肝细胞 Miz1 的缺失促进IKK介导的MTDH的磷酸化,从而促进了 NF-κB 的激活和 NF-κB 下游炎症相关靶基因的表达。

3. 肿瘤特有肝细胞分泌细胞因子促进肿瘤浸润巨噬细胞向促炎表型转化
对巨噬细胞亚群和肝脏特有巨噬细胞(Kupffer cell)进一步细分,并进行差异基因分析和Qusage分析,发现Miz1∆hep小鼠的肿瘤浸润巨噬细胞和 Kupffer 细胞的一些亚群NF-κB 强烈激活,肿瘤浸润巨噬细胞向促炎表型转化。

究其原因,研究者发现,肿瘤特有的肝细胞能促进炎性细胞因子分泌(TNF-α,IL-1β, IL-6等)和相关基因表达,驱动肿瘤浸润的巨噬细胞向促炎表型倾斜,巨噬细胞受其驱动,IL-1β, IL-6的基因表达上调,促炎性细胞因子增加并驱动了HCC中的炎症。对炎性巨噬细胞消除处理(GdCl3)后,小鼠肝脏/体重比、最大肿瘤直径有所恢复。

Miz1抑制肿瘤发生机制在于:1.Miz1与RelA竞争结合癌蛋白MTDH。2.抑制IKK酶活性降低MTDH磷酸化。相关临床试验也证实了Miz1在不同HCC患者中的表达与肝细胞RelA和MTDH的磷酸化呈反相关,与HCC患者复发和整体预后也密切相关。


总的来说,本研究基于单细胞测序和其它组学分析,结合多种体内、体外实验,发现小鼠肝细胞中转录因子Miz1缺失,产生了高表达NF-κB下游炎症因子的特异性“炎性”肝细胞亚群,激活肿瘤浸润巨噬细胞向促炎表型转化,增强肝脏炎症反应,促进肝癌的发生发展。