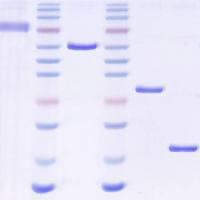
最小抑菌浓度(MIC)及抑菌率的测定
互联网
提纯蛋白质后,需要测定其最小抑菌浓度(MIC),有文献提到根据MIC测得的结果计算抑菌率:
抑菌率(%)= (阳性对照OD值—试验OD值) / (阳性对照OD值—阴性对照OD值 )X100
样品的MIC与同性质药物和一些常用药物的MIC进行比较才有意义,不能单纯通过自己样品的结果就判断出高低,并且不能只用一种细菌。要考虑用不同种类的细菌进行实验,还要做质控。根据抑菌率大小可以判断是否具有抑菌能力。
可参考以下药敏介绍:
诸多药敏试验方法中,肉汤稀释法是标准方法,琼脂稀释法也可认为属于标准方法。其他任何方法必须与标准方法比较,才能确定可靠性。其他方法之间相互比较没有太大价值。比较须平行测定耐药菌株和敏感菌株。耐药菌株,被评价方法与标准方法的误差称极重要误差,不得大于3%;敏感菌株,被评价方法的误差称重要误差,不大于7%。
不同的药敏试验方法,针对不同药物,可靠性不一样。如测MRSA须高盐条件,有的试剂盒中不加盐,结果不准确,但这不影响肠球菌的测定结果。所以,评价一种方法,应该是有针对性地验证一种细菌对一种药物测定结果的可靠性。
质量控制及其校准作用
1、纸片法药敏试验
用敏感菌株做质量控制。此外,ATCC25923,ATCC25922,ATCC27853三个菌株还具备校准作用,此点往往被忽视。在NCCLS有关文件中,质量控制一节的第一部分就是讲方法的校准。由于培养基和操作的原因,国内大部分实验室的药敏试验没有经过校准,试验的准确度差异很大。校准过程中,须注意用适合的参考菌株校准相应菌类的药敏试验。如葡萄球菌药敏试验用ATCC25923校准;肠杆菌药敏试验用ATCC25922校准。
2、筛选法药敏试验
必须用耐药菌株做质量控制,最好是低水平耐药菌株。MRS筛选试验以ATCC43300控制。万古霉素筛选试验,以ATCC51299控制。
3、稀释法药敏试验
对质量控制要求较高,特别是微量稀释法,必须做质量控制,否则会出现较大误差。具体方法须依照NCCLS文件的有关部分。
与不同的菌种和不同的药物,breakpoint 是不一样, 对于抗菌实验和结果解释,不同的国家有不同的标准,目前国际上最常用的是美国CLSI的标准,差不多每年都会有更新。其次英国的BSAC标准也有人用,尤其是有些新药在CLSI上没有的,可以参考BSAC, 相对于CLSI, BSAC breakpoint 更低一些。