Science:学术「自嗨」还是开创性的发现? 聚焦「相分离」研究引发的学术争议
丁香学术
554
「相分离」(液液相分离)本是高分子物理学中的概念,近年来却在生物医学领域引起前所未有的重视,几乎每一项新的突破都会登顶 CNS,然而着这个理论的发展却一直伴随着近乎极端的争议!
Science 近期更是发出灵魂质问,Sloppy science or groundbreaking idea? (潦草的科学还是开创性发现?)

图片来源:Science
带着这样的疑问,我们从头梳理一下相分离研究的发展,看看它到底解决了什么问题,又为何会引起巨大的争议,未来的路又该怎么走?
相分离
为了方便大家理解什么是相分离,这里再介绍一种常见的现象:乳化。
其实,乳化是指一种液体以微小的液滴均匀地分散在另一种互不相溶的液体里的现象,例如把油和水放在一起剧烈震摇,你就会得到浑浊的分散体系(乳浊液),这样的体系并不是均一的,而是仍然由水和油两相构成,即是一种常见的相分离现象。
人们普遍认为细胞质基质只是一种水相体系,可以形象地将其比作一锅溶解了各种诸如无机盐、氨基酸等小分子以及诸如蛋白质、RNA 等大分子的「浓汤」,那么细胞质基质会发生乳化吗?
相分离研究就是建立在这个基础上,生物学家们借助它来理解细胞中无膜细胞器的形成机制。
相分离与无膜细胞器
面对神奇的生命,每一位生物学家可能都曾有过这样的疑问:细胞是如何在拥挤狭小的空间内井井有条地开展复杂多样的生命活动的呢?
众所周知,酶促反应在实现细胞生理功能的过程中发挥着至关重要的作用,从而细胞要想精准控制各种生命活动,就需要在特定的时间和空间内调控这些酶促反应。
其中一个重要策略就是把执行某种或某类特定功能的酶及其底物在特定的时间集合到特定的空间,从而形成一个独立的区室,既促进了反应发生,也避免了细胞质中大量无关物质的干扰。真核细胞中的线粒体、高尔基体、内质网等各种有膜细胞器便是这样的典范。
然而,早在 1898 年,Montgomery [1] 和 Wilson [2] 等人便发现了细胞中还存在着诸如核仁这样的无膜区室,这是一片包含了多种物质的浓缩区域,承担着特定功能。这一发现自然引起了生物学家的思索:没有磷脂膜的约束,细胞又是如何把多种蛋白质、核酸、小分子等成分聚集到一起呢?
答案或许就是本文的主角 —— 液液相分离。
尽管无膜细胞器的存在已经被人们知晓了一个多世纪,但是生物学家们对其背后的形成机制却知之甚少,直到最近十年左右,液液相分离(liquid-liquid phase separation,LLPS)的观点横空出世。
一切回溯到 2009 年仲夏。
来自德国马克斯∙普朗克研究所的 Clifford P. Brangwynne 团队在 Science 发表了一篇题为 Germline P Granules Are Liquid Droplets That Localize by Controlled Dissolution/Condensation 的重磅文章 [3],

图片来源:Science
他们在研究线虫的胚胎细胞时发现蛋白质和 RNA 会在细胞的一侧自发的凝聚形成小液滴状结构,称之为「P granules」,其能够展现出融合、润湿、流动等液体行为,并且随着相关成分浓度的变化,P granules 会迅速的解体或者凝聚。这些现象都指向了 LLPS。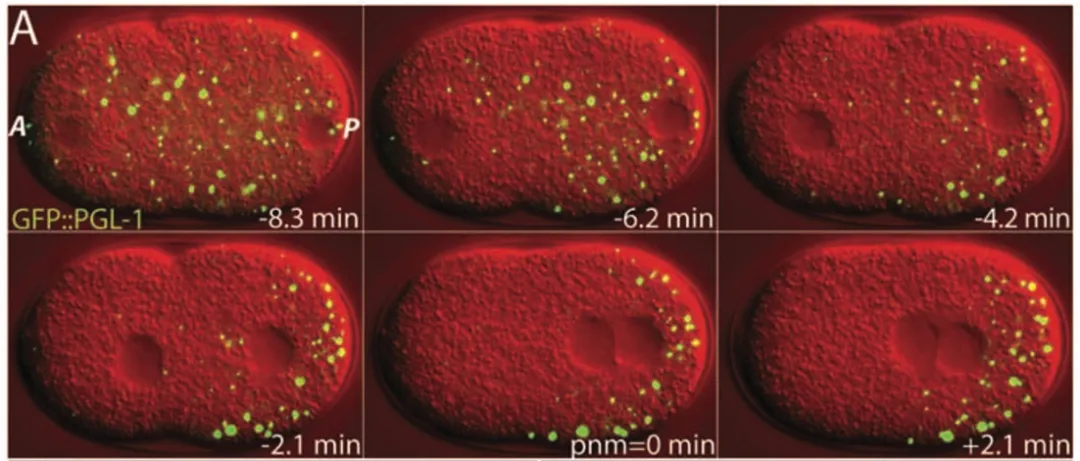

图片来源:Ref. 3; Science
2 年后,Clifford P. Brangwynne 团队又在「核仁」中发现了类似的浓缩液滴状结构,这一篇题为 Active liquid-like behavior of nucleoli determines their size and shape in Xenopus laevis oocytes 的文章刊登在了 2011 年的 PNAS 上。
 图片来源:PNAS
图片来源:PNAS受到高分子物理学中对于相分离理论研究的启发,生物学家们也由此进行了细胞中蛋白质液液相分离形成的分子机制的探索。
研究发现,细胞中各种蛋白质和核酸成分发生 LLPS 的分子基础是形成「多价且低亲和力」的相互作用 [4],例如疏水作用、静电相互作用等,当这些成分的含量超过某一「临界浓度」时(过饱和),分子就会自发的凝聚而形成新的液相,即发生了液液相分离。
 图片来源:Trends in Cell biology
图片来源:Trends in Cell biology影响 LLPS 的因素除了临界浓度以外,还涉及到细胞内的环境因素,例如温度、pH、离子强度等等,这些因素之间的关系可以大致用一个相图来描绘。
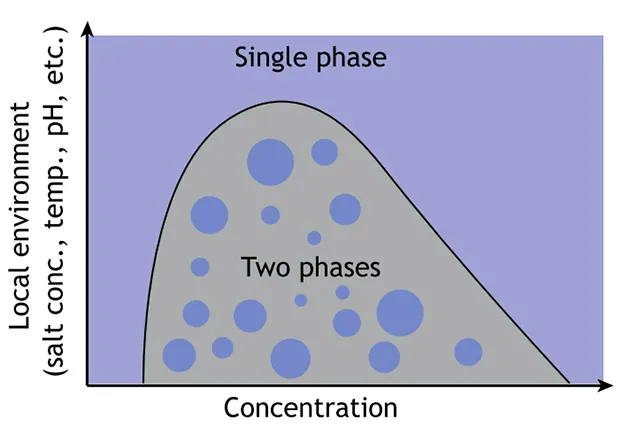 图片来源:Development
图片来源:Development 一朝发现,解决百年难题
细胞内的「乳化」重要吗?有何意义?
细胞内 LLPS 的提出能够回答困扰了生物学家一百多年的问题!即细胞在执行特定的工作时是如何有效地组织其内含的各种分子,使其出现在特定的时间和空间。
Clifford P. Brangwynne 的研究引起了生物学家们极大的兴趣,相关的研究结果在几年间「井喷式」的涌现。研究者们后续又发现了多种与 LLPS 有关的细胞结构 [5],例如 stress granules、Cajal bodies,甚至还有异染色质等等。

图片来源:Nature Biotechnology
相关研究表明 LLPS 在细胞内发挥着重要的生理功能,例如提高生化反应速率,调节核质中游离蛋白的浓度,调控染色质结构以及基因表达等等。
此外,异常的 LLPS 也与疾病的发生有关,例如肿瘤和肌萎缩性脊髓侧索硬化症(ALS)等神经退行性疾病。默克、拜耳等医药巨头也斥巨资进入了这一领域。
在 2018 年,LLPS 正式入选了 Science 杂志评选的十大科学年度突破。
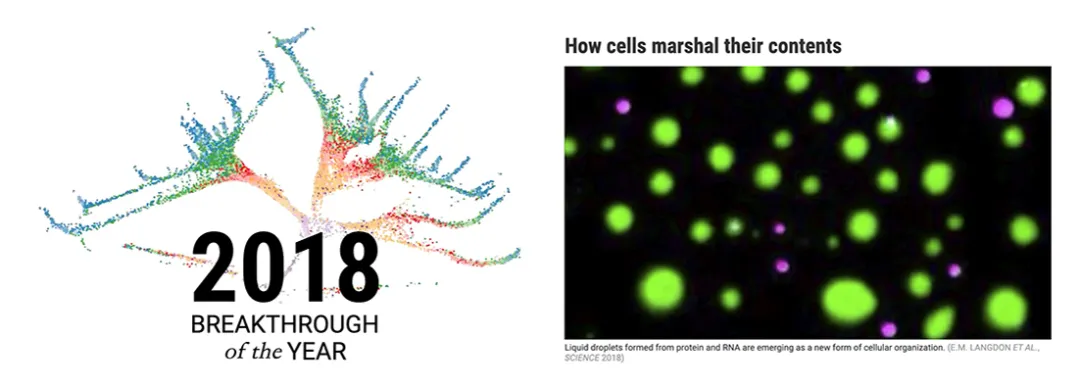 图片来源:Science
图片来源:Science一盆冷水:眼见不一定为实?
LLPS 尽管是当今细胞生物学中最炙手可热的研究领域之一,相关文章成为了各大顶刊的常客,但仍然有一些谨慎的科学家对此保持了怀疑的态度。
2019 年,Mustafa Mir 等科学家特意开展了一个研讨会以分析 LLPS 是否真的参与了基因调控,相关的结果文章 Chromatin topology, condensates and gene regulation: shifting paradigms or just a phase? 以「spotlight」的形式刊登在 development 杂志上。
此外,LLPS 现象的早期发现者之一,来自美国加州大学伯克利分校的 David T. McSwiggen 和他的导师 Robert Tjian 重新审视了 LLPS 领域的 33 篇研究工作,却遗憾的发现大部分研究得出的结论都是基于定性的、描述性的证据!
他们认为 LLPS 尽管不一定在根本上是错误的,却指出目前的相关研究普遍缺乏定量的实验方法以及可靠的数据。
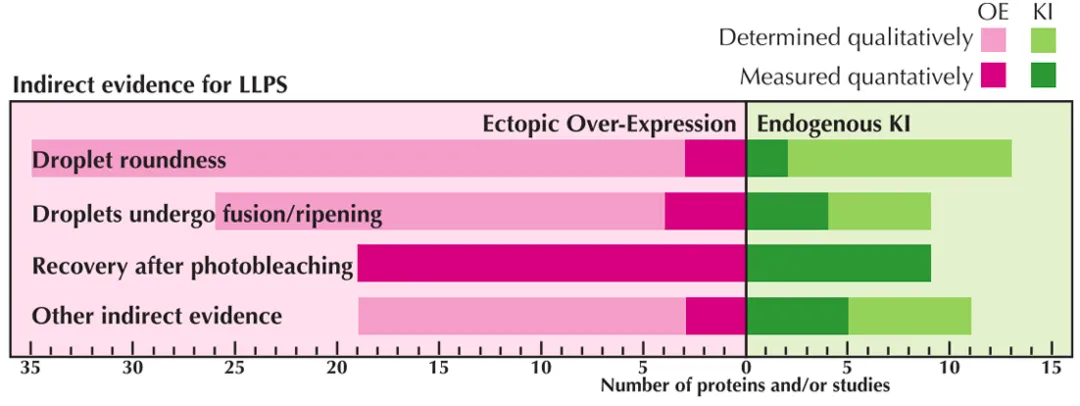
图片来源:Genes & Development
这篇题为 Evaluating phase separation in live cells: diagnosis, caveats, and functional consequences 的文章 [6] 无疑给 LLPS 相关领域的研究者们泼了一盆冷水,但是也促使人们更加理性、严谨的分析细胞中那些疑似与 LLPS 有关的现象。
 图片来源:Genes & Development
图片来源:Genes & Development实际上,研究者们已经因为过度依赖定性的实验方法而获得了深刻的教训!
人们过去鉴定细胞中某个结构是否与 LLPS 有关,主要通过观测其是否具有液滴的性质,例如近似球形,融合与分裂,折射率差异等等。但是受到光学显微镜分辨率限制等诸多因素的影响,以上的观测结果可能并不准确,即眼见不一定为实!
 图片来源:Genes & Development
图片来源:Genes & Development此外,研究者们在鉴定参与 LLPS 的相关蛋白成分时也大多通过简单的体外实验或者胞内异源超表达的方式,但是考虑到胞内环境的复杂多样以及浓度等因素,这样的模拟实验中得出的结论在细胞内的自然状态下是否可靠依然是未知。
当然,目前仍然有少数的定量方法被运用于 LLPS 的研究中。其中具有代表性的是表征液液分离相内分子动力学特性的「光漂白荧光恢复实验」(fluorescence recovery after photobleaching,FRAP)。
它通过光漂白特定区域后再测定荧光恢复时间,理论上液态体系的分子具有较大的运动性,而周围未被漂白的荧光分子会由于扩散作用进入漂白区域从而使荧光得以逐渐恢复,这样的实验可以证明研究对象具有液体的分子运动性。
然而不同文献中报道的 FRAP 恢复时间差异很大,从亚秒到数分钟不等,这是因为 FRAP 结果受到浓度、结合与扩散、仪器等多种因素影响,所以很难将 FRAP 看作鉴定 LLPS 的严谨标准。
甚至有科学家指出,FRAP 的结果只能说明你看到了一团液体,但是细胞内处处是液体!
 图片来源:Nature biotechnology
图片来源:Nature biotechnology实际上,即使某个结构满足了上述所有定性特征,也可能是源于 LLPS 以外的其他机制。
一个令人警醒的典型案例是,单纯疱疹病毒感染细胞后会形成一种特殊的复制区室,人们曾认为这与 LLPS 有关,因为它看起来符合了 LLPS 的所有特点:圆形、融合、不同的折射率、体外试验中发生凝聚。
但是后续对其进一步做单分子追踪实验后却发现,复制区室相比于周围的核质环境,其分子扩散速率并未变慢 [7],这显然不符合 LLPS 稠密区域内分子扩散速率将更加缓慢的特征。实际上,后来的研究发现这一复制区室是通过 DNA 招募相应的蛋白质所形成的。

图片来源:elife
前进的方向:定量新技术的出现
为了更加准确的鉴定和研究细胞内的 LLPS,研究者们迫切需要新的技术手段,而目前也已经出现了一些令人振奋的成果。
光学显微镜和光谱学的发展使得人们可以定量的测定和比较相分离体系中蛋白质的绝对丰度。单分子追踪技术也将取代 FRAP 成为研究分子动力学特性更好的方法。此外,光或者小分子调控的 LLPS 实验模型也纷纷出现。
2018 年 Brangwynne 团队在 Cell 上发表了题为 Mapping Local and Global Liquid Phase Behavior in Living Cells Using Photo-Oligomerizable Seeds 的研究论文 [8],他们开发出了一种名为「Corelet」的光诱导相分离技术,将参与 LLPS 的蛋白片段融合到光诱导二聚的 iLID 和 SspB 蛋白上,当给予特定光照时可诱使分子立刻凝聚从而出现 LLPS 现象。
这一技术使得研究者可以同时在体外实验和体内实验中更精确地研究相分离所需的蛋白质浓度以及参与 LLPS 的蛋白质结构域。

图片来源:Cell
写在最后
总之,LLPS 领域的研究曾在过去几年迎来井喷式发展,其研究论文的质量却良莠不齐,人们近乎走到了急功冒进的误区。
但正如科学史上的任何新潮事物一样,最终都会淘尽糟粕,留存真理。现在需要的只是时间和审慎。
相信不久的将来,LLPS 在细胞生理学以及疾病发生中的重要作用将被进一步揭开和证实,从而有力地推动生命科学的发展,助力肿瘤、神经疾病等领域的新药研发。
或许,地球上的生物已经进化了漫漫数亿年,而在最初那片小小的原始汤中悄然发生的液液相分离,正是这一切的种子。
本周推荐:
三句话读懂一篇 CNS!首次提取超 100 万年的 DNA;轻轻一喷,瞬时改变作物性状...
参考资料