Brain报道最新疗法:治疗阿兹海默症,只需光与氧!
丁香学术
154
阿兹海默症(AD),是世界上患病人数最多的神经退行性疾病。折磨着近五千万中老年人,并给他们的家庭带来了沉重的负担。
日益严峻的老龄化危机,使得确诊 AD 的人数正以一千万每年的速度飙升。令人遗憾的是,尽管科研院校与医药企业每年都投入大量的资金来寻找治疗与预防 AD 的方法,但几十年来,人类在对抗 AD 的战争中屡战屡败,至今并未找到任何能够有效治疗 AD 的药物。
导致 AD 无药可用的一个重要原因就是,血脑屏障的存在使得大分子药物难以触及疾病发生的位置,能够跨过血脑屏障的小分子药物因此开始受到医学界的重视。

图片来源:Brain
2021 年 4 月 14 号,来自日本东京大学的 Taisuke Tomita 教授与 Motomu Kanai 教授联合带领团队,在大脑研究领域著名期刊 Brain 发表了题为 Photo-oxygenation by a biocompatible catalyst reduces amyloid-b levels in Alzheimer’s disease mice 的研究 [1],报道了他们使用光氧疗法治疗 AD 的尝试,为 AD 的治疗提供了全新的思路。
研究内容: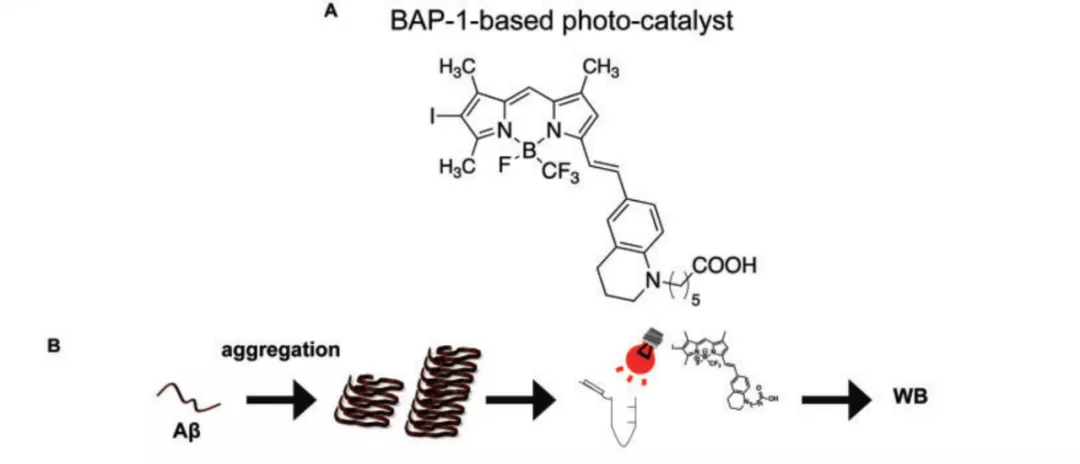

图片来源:Brain
此前有研究证明光氧合(Photo-oxygenation)可以显著抑制 β 淀粉样蛋白的聚集与细胞毒性。为了在体内对大脑中的光氧合进行更好的调控,研究团队对常规用来探测大脑内 β 淀粉样蛋白聚集的 BAP-1 探针进行了改造,以此建立了具有光催化功能的 BAP-1 光触媒。这种催化剂分子量极小,能够轻易到达 β 淀粉样蛋白(Aβ)聚集的区域。
图片来源:Brain
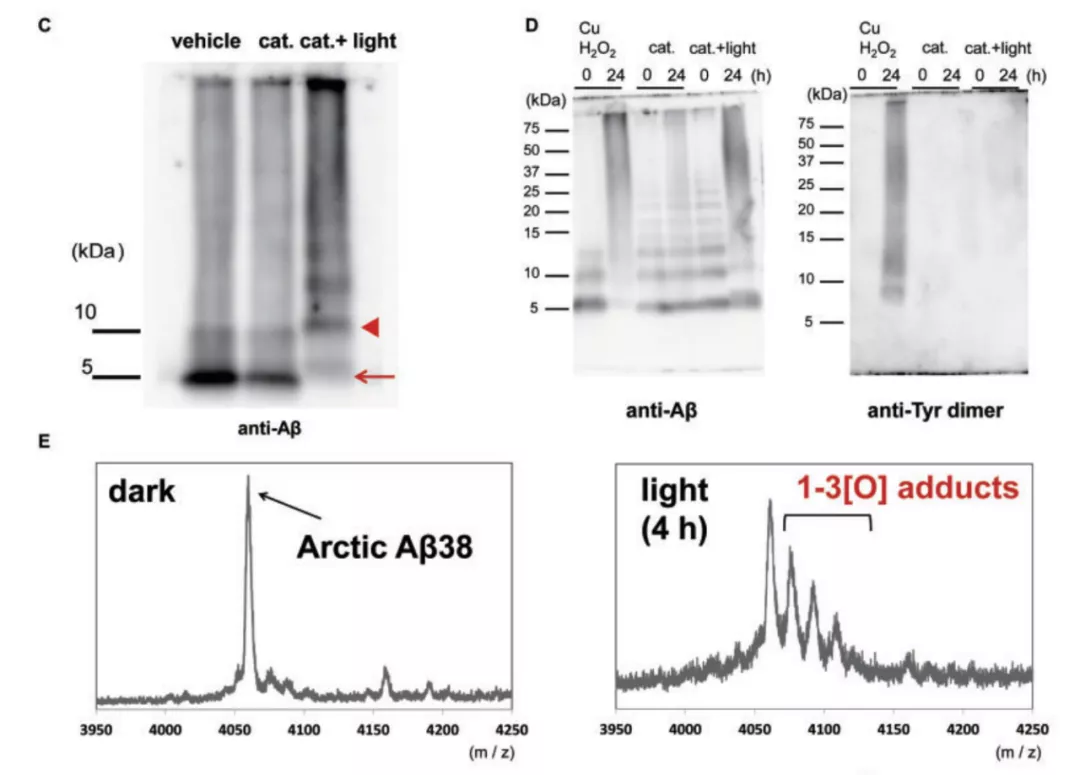
体外实验结果显示,使用 660nm 的近红外光线照射 BAP-1 光触媒,能够将分子量为 5kDa 的 β 淀粉样蛋白,光氧合为分子量为 10kDa 的 β 淀粉样蛋白。这种改变被 Western blot 和质谱分析证明。同时,在从 AD 病人脑中分离出来的 β 淀粉样蛋白中使用 BAP-1 光触媒并加以光照,也能得到一样的结果。这些数据证明,BAP-1 光触媒能够有效的促进 β 淀粉样蛋白的光氧合。
图片来源:Brain
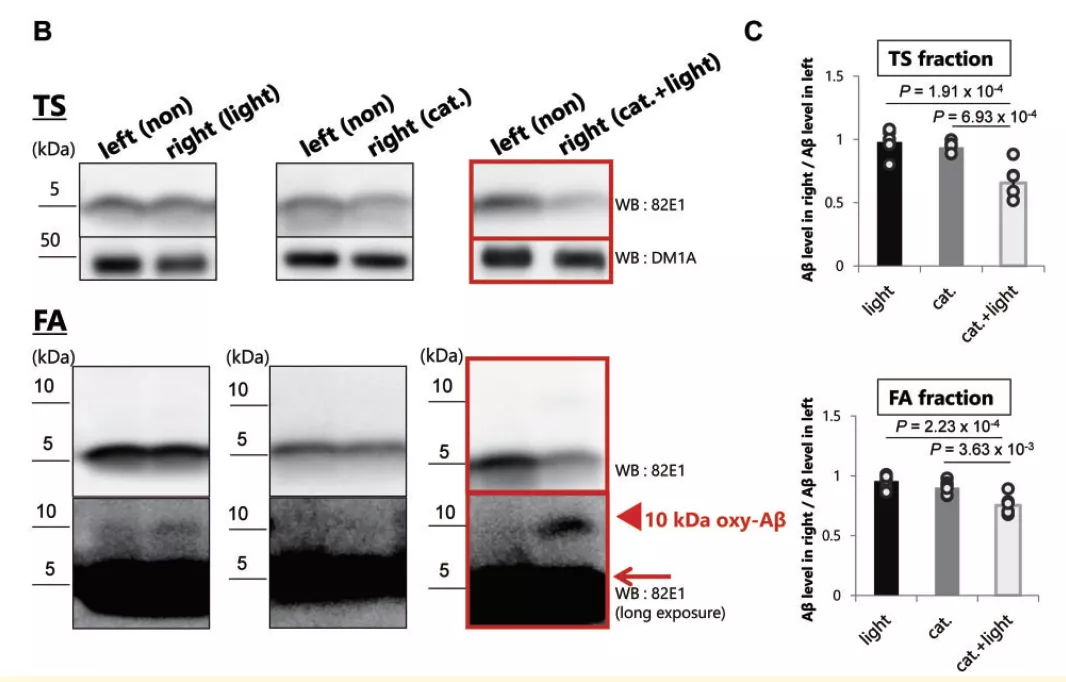
随后,研究团队往 AD 小鼠的海马区中注射了 BAP-1 光触媒,并进行了光激活。通过分析脑中的成分,作者得到了和体外实验一致的光氧合现象。结果显示,无论是在可溶组分还是不可溶组分中,单体 Aβ 成分都得到了显著的下降。而这种下降,极有可能是由光氧合后,Aβ 变得不稳定导致的。
图片来源:Brain
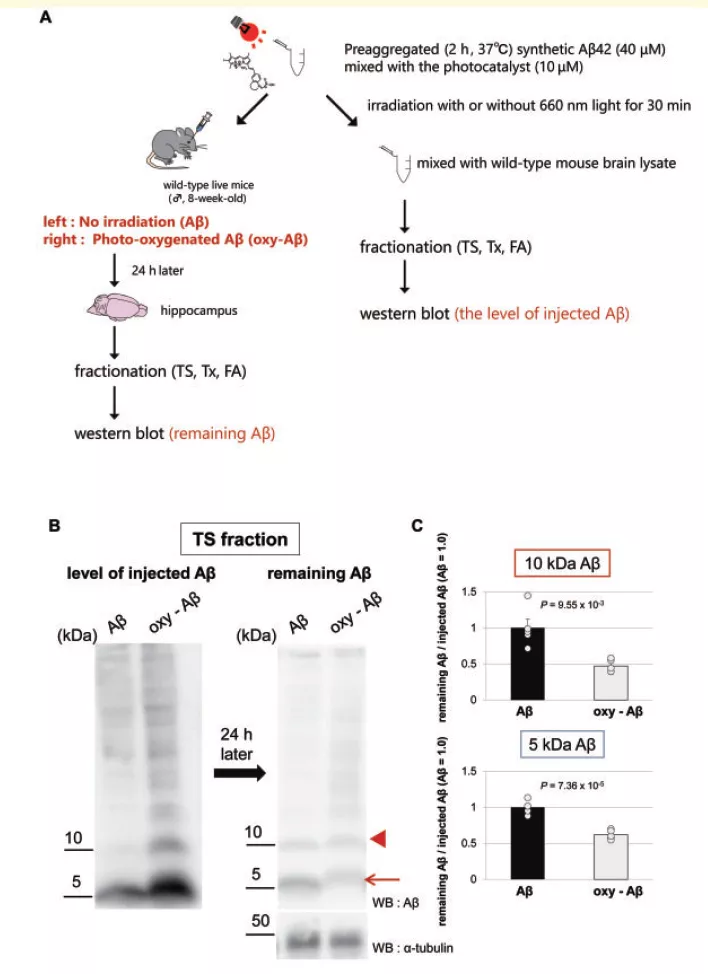
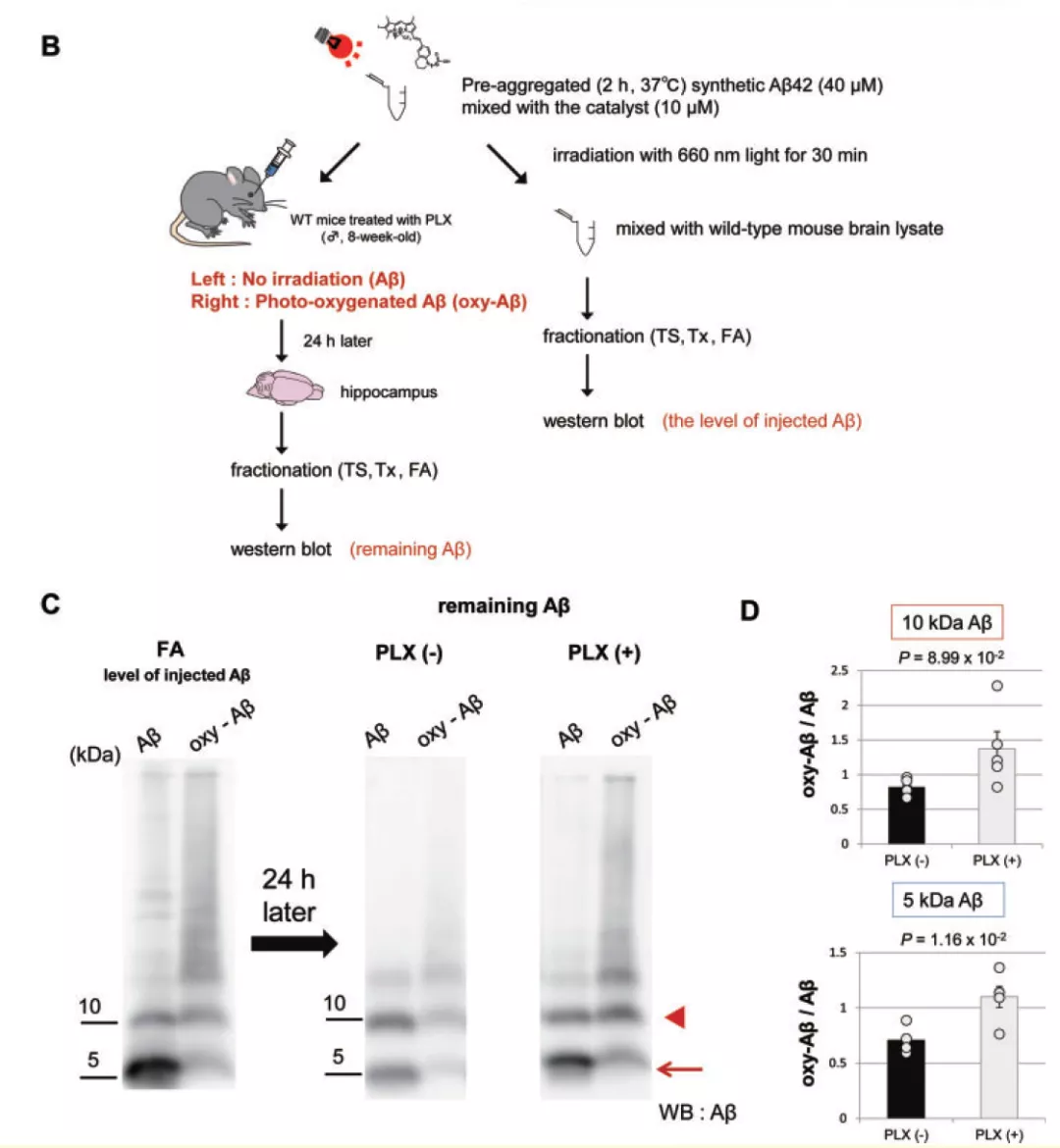
为了验证光氧合后的 β 淀粉样蛋白更容易被清除,研究团队将使用 BAP-1 光触媒氧合后的 β 淀粉样蛋白(Aβ)与对照组 Aβ 注射进了健康的小鼠脑中,并在 24 小时后检测大脑中残余的 Aβ 含量。结果显示,注射未光氧合 Aβ 的小鼠脑中的 Aβ 几乎没有被清除,而注射光氧合 Aβ 的小鼠脑中残余的 Aβ 显著低于对照组。这些数据进一步表明光氧合促进了 β 淀粉样蛋白的清除。
由于此前由研究报道小神经胶质细胞能够吞噬 Aβ,并通过溶酶体降解 Aβ。因此,研究团队随后探究了小神经胶质细胞是否与光氧合诱导的 Aβ 清除有关。
图片来源:Brain
在使用 Pexidartinib 清除过小神经胶质细胞的小鼠脑中,光氧合过的 Aβ 无法再被有效的清除,这证明小神经胶质细胞对光氧合 Aβ 的降解至关重要。

图片来源:Brain
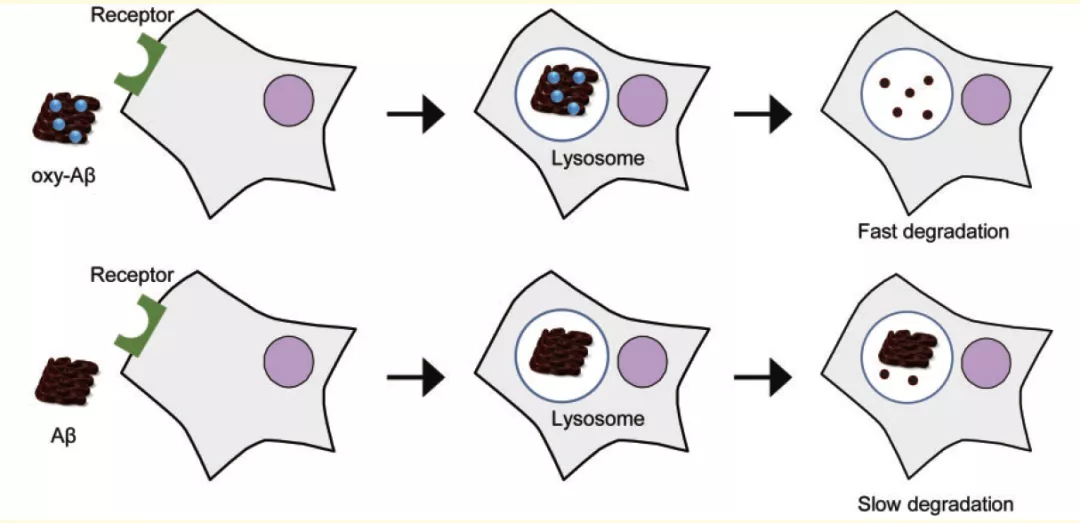
最后,研究团队对 Aβ 的光氧合是如何加速小神经胶质细胞对其的清除,进行了细胞层面的探索。Aβ 摄取实验结果显示,光氧合并不能显著加速小神经胶质细胞对 Aβ 的识别与摄取。但在相同的时间内,小神经胶质细胞中光氧合 Aβ 的含量,总是低于天然 Aβ 的含量,这意味着 Aβ 的光氧合加速了 Aβ 在小神经胶质细胞中的降解,而不是识别。通过亮抑酶肽抑制蛋白酶的活性,几乎完全抑制了小神经胶质细胞对光氧合 Aβ 的加速清除作用。有趣的是,在星形胶质细胞中,作者没有观测到类似的清除现象。这些数据证明,是小神经胶质细胞对 Aβ 的降解效果因光氧合得到了提升,最终导致 A β 在脑中的聚集减少。
研究意义:
图片来源:Brain
该研究再次证明了使用光催化 Aβ 的氧合,是一种有效清除 Aβ 以治疗 AD 的方法,并在动物实验中证明了其可行性。同时,该研究还对光氧合 A β 是被何种细胞清除,以及如何清除进行了机制层面的初步探索。在今后的研究中,希望研究团队能针对光氧合 Aβ 清除的分子机制进行更进一步的研究,以识别出调节出其降解的关键因子。
延伸阅读:
Taisuke Tomita 与 Motomu Kanai 团队对使用光氧合治疗 AD 的初次报道,可以追溯到 2016 年。

图片来源:Nature Chemistry
2016 年,本文的通讯作者之一 Motomu Kanai,在 Nature 子刊 Nature Chemistry 上发表了题为 Switchable photooxygenation catalysts that sense higher-order amyloid structures 的研究 [2], 首次报道了他们能够在体外用光控制开光的光氧合催化剂,并选择性的氧合包括 β 淀粉样蛋白在内的多种蛋白结构。其选择性与可控性,为聚集性致病蛋白的靶向,提供了新的契机。
随后,Motomu Kanai 对这些光触媒进行过多次优化。可遗憾的是,由于这些光触媒的激活必须使用可见光,它们的应用也一直被局限在体外。

图片来源:Chem
2 年后,Motomu Kanai 团队再次在 Cell 子刊 Chem 上发表了题为 Near-Infrared Photoactivatable Oxygenation Catalysts of Amyloid Peptide 的研究 [3], 首次使用近红外光实现了淀粉样蛋白的光氧合,为相关技术的体内使用扫清了障碍,也因此有了这项发表在 Brain 的工作。

图片来源:Chemical Communications
当然,如此强大的技术当然也不局限于 β 淀粉样蛋白。2019 年,Taisuke Tomita 教授与 Motomu Kanai 教授联合在 Chemical Communications 上发表了题为 Photo-oxygenation inhibits tau amyloid formation 的研究 [4],报道了 使用光氧合技术同样能够抑制另外一种 AD 关键蛋白 tau 蛋白形成聚合物。
光氧合技术的使用,无疑为陷入困境的 AD 药物研发开启了一扇全新的大门。我们也衷心希望,数以千万计的 AD 的患者,能在不久的将来享受到这项技术带来的成果。
本周推荐:
美少女福音!Science 重磅报道,他们率先实现皮肤无疤痕愈合
眼看它就要封神了...Science 报道烟酰胺可增强胰岛素敏感性、促进肌肉重塑
参考资料