让肿瘤变「热」!宋尔卫院士团队Nat Immunol发文报道肿瘤免疫治疗新策略
丁香学术
385
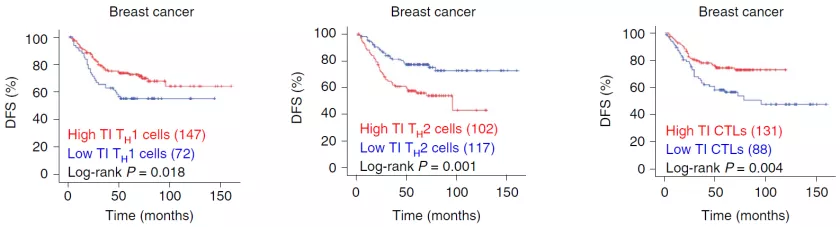
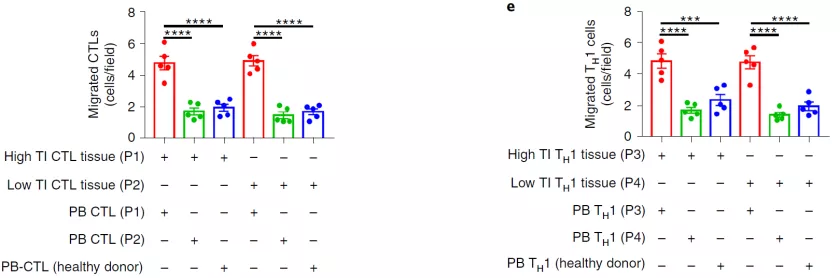
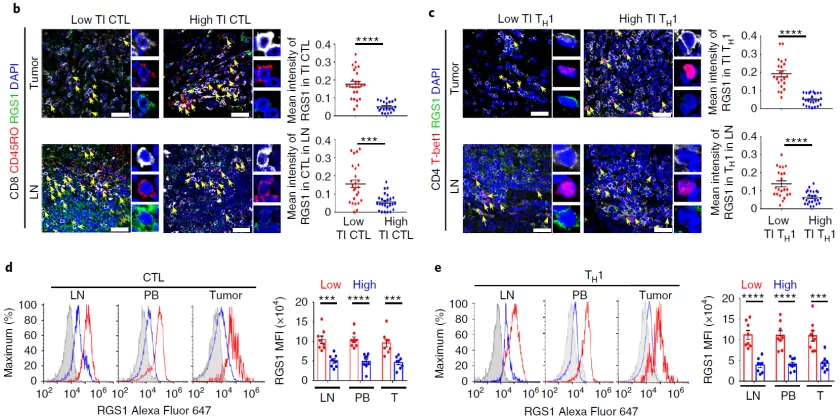
T 细胞向肿瘤迁移和浸润对于抗肿瘤免疫反应有着关键作用,然而许多肿瘤(例如乳腺癌)中浸润的淋巴细胞很少,导致这类癌症对免疫治疗不敏感 。
哪些因素影响着 T 细胞向肿瘤迁移的能力目前尚不清楚。因此,寻找促进 T 细胞向肿瘤迁移的策略,使「冷肿瘤」转变为「热肿瘤」,对于增强肿瘤免疫治疗效果具有重要意义。

参考文献
1. Y. T. Liu, Z. J. Sun, Turning cold tumors into hot tumors by improving T-cell infiltration. Theranostics 11, 5365-5386 (2021).
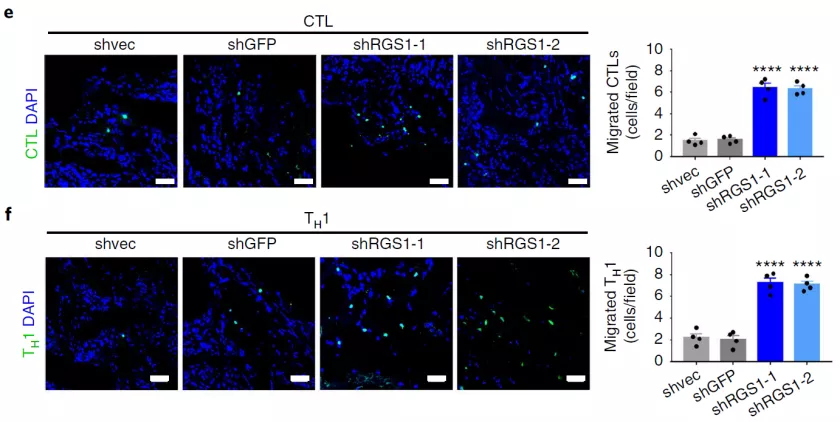
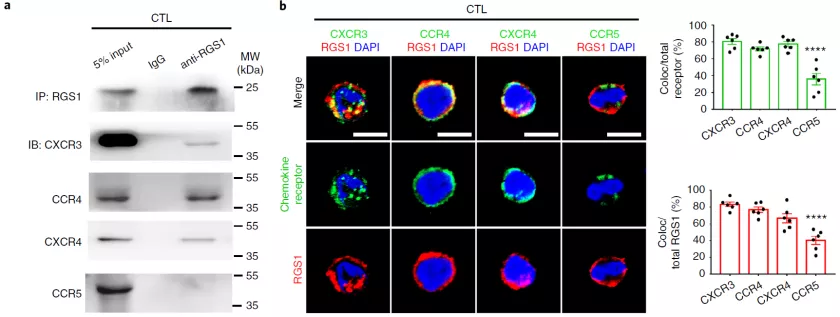
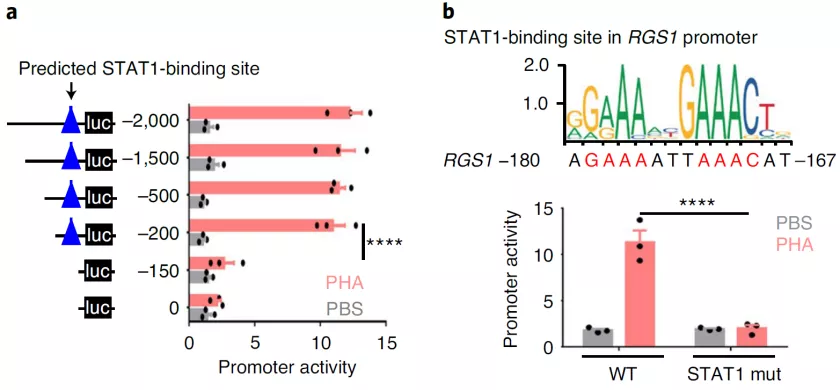
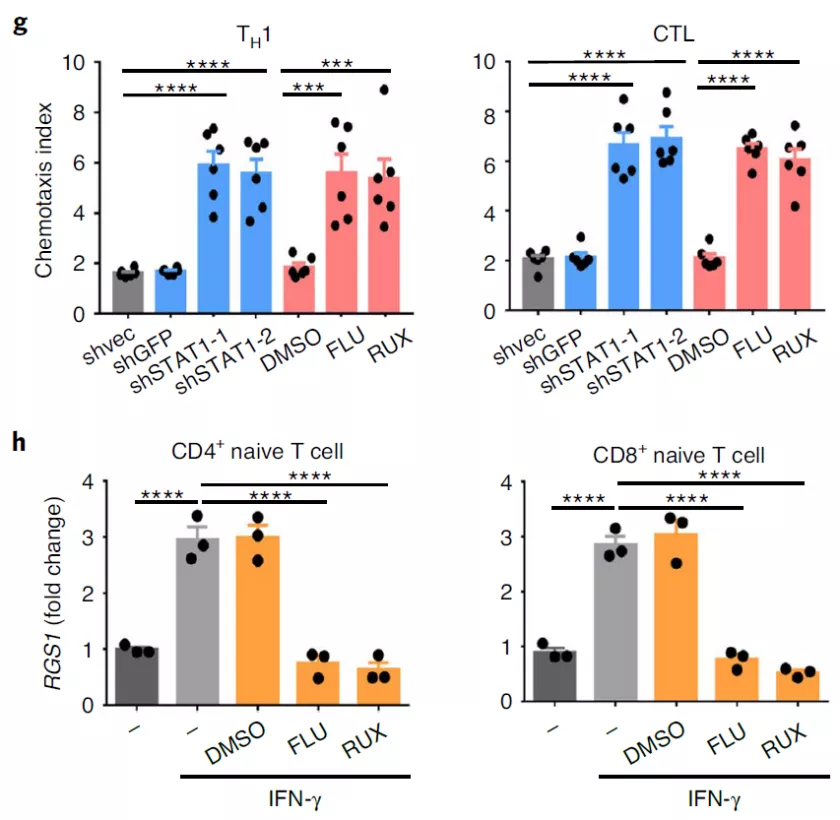
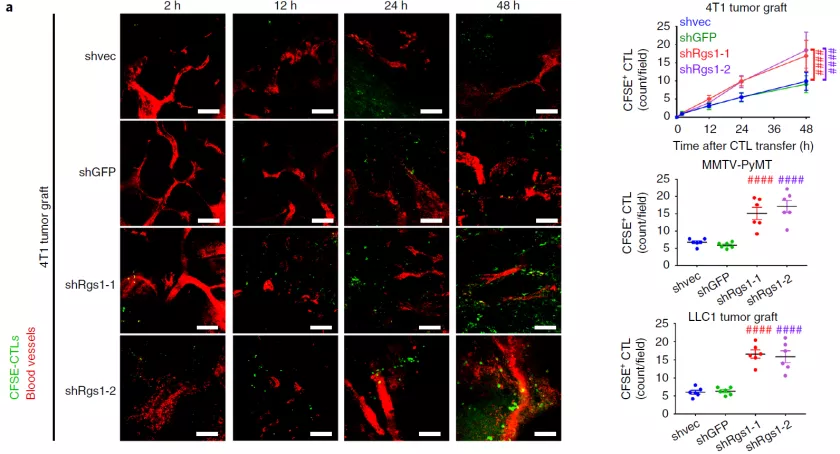
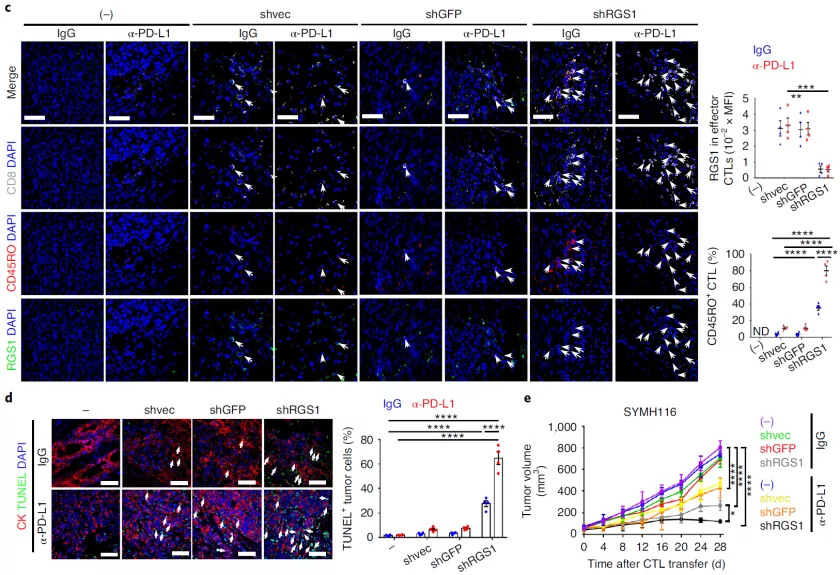
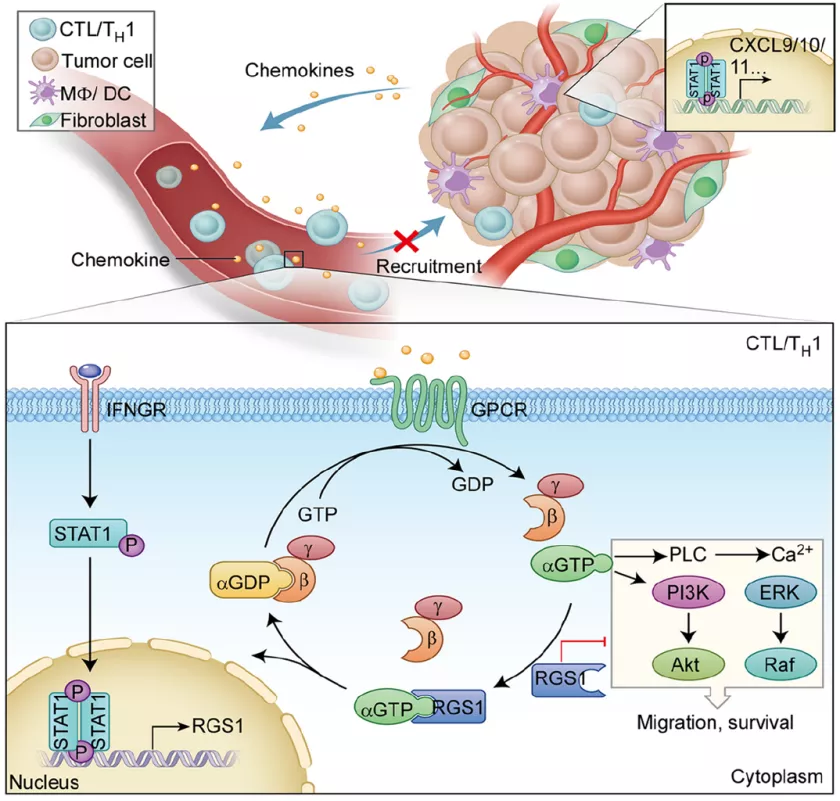
2. D. Huang et al., Targeting regulator of G protein signaling 1 in tumor-specific T cells enhances their trafficking to breast cancer. Nat Immunol, (2021).
3. Ross, E. M. & Wilkie, T. M. GTPase-activating proteins for heterotrimeric G proteins: regulators of G protein signaling (RGS) and RGS-like proteins. Annu. Rev. Biochem. 69, 795–827 (2000).
4. D. Huang et al., NKILA lncRNA promotes tumor immune evasion by sensitizing T cells to activation-induced cell death. Nat Immunol 19, 1112-1125 (2018).
5. J. Hu et al., T-cell Homing Therapy for Reducing Regulatory T Cells and Preserving Effector T-cell Function in Large Solid Tumors. Clin Cancer Res 24, 2920-2934 (2018).
6. L. A. Emens et al., Long-term Clinical Outcomes and Biomarker Analyses of Atezolizumab Therapy for Patients With Metastatic Triple-Negative Breast Cancer: A Phase 1 Study. JAMA Oncol 5, 74-82 (2019).
7. F. Fercoq, L. M. Carlin, "Mind the GAP": RGS1 hinders antitumor lymphocytes. Nat Immunol, (2021).
8. Z. Liu et al., Tumor Vasculatures: A New Target for Cancer Immunotherapy. Trends Pharmacol Sci 40, 613-623 (2019).
9. L. Jin et al., CXCR1- or CXCR2-modified CAR T cells co-opt IL-8 for maximal antitumor efficacy in solid tumors. Nat Commun 10, 4016 (2019).
10. L. Zhao, Y. J. Cao, Engineered T Cell Therapy for Cancer in the Clinic. Front Immunol 10, 2250 (2019).
11. S. P. Kubli, T. Berger, D. V. Araujo, L. L. Siu, T. W. Mak, Beyond immune checkpoint blockade: emerging immunological strategies. Nat Rev Drug Discov, (2021).
题图来源:站酷海洛 Plus
![2-iodo-[¹²⁵I]5MCA-NAT,Moligand™,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/785/8670042233826733081.jpg!wh200)