艾滋病、白血病向「治愈」迈进一大步,邓宏魁 / 陈虎合作团队 NEJM 报道首例 CRISPR 编辑干细胞治疗艾滋病和白血病患者
获得性免疫缺陷综合症 (艾滋病,AIDS) 自 1981 年首次发现以来,一直是困扰科学家的重要疾病之一。尽管对艾滋病的临床治疗已有了很大进展,但仍无有效治愈手段。
CCR5 作为 G 蛋白偶联因子超家族 (GPCR) 成员的细胞膜蛋白,是 HIV-1 入侵机体细胞的主要辅助受体之一。已有研究表明,通过造血干细胞 (HSPCs) 的异体移植,加上自然发生的 CCR5 突变,可以长期消灭 HIV-1 型病毒。
在过去 20 年里,基因编辑一直是基础科学研究的有力工具。近年来,随着第三代基因编辑技术 ——CRISPR/Cas9 的开发和应用,基因编辑开始向高效性、便捷性发展,并越来越多的应用于精准医疗领域研究。
2019 年 9 月 11 日,北京大学 - 清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎(7 月 24 日下午因突发心脏病抢救无效去世,享年 57 岁)。研究组以及首都医科大学附属北京佑安医院吴昊研究组合作在 The New England Journal of Medicine 发表了题为《CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia》的研究论文。
该研究是世界首例通过 CRISPR/Cas9 基因编辑手段编辑造血干细胞并移植进艾滋病和急性淋巴细胞白血病患者对其进行治疗的案例。加州大学伯克利分校 Fyodor Urnov 对其评价为:「这是在使用基因编辑技术治疗人类疾病道路上迈出的重要一步。」

图片来源:NEJM
文章亮点
1、利用 CRISPR/Cas9 技术对同种异体造血干细胞进行基因编辑敲除了 CCR5,并移植进同时患艾滋病和白血病的患者体内。
2、白血病症状得到完全缓解,而携带敲除 CCR5 的供体细胞持续存在 19 个月以上,没有发生与基因编辑相关的不良事件。
3、初步证明了基因编辑造血干细胞在临床应用中的可行性与安全性。
文章思路
该患者在被确定患有艾滋病和白血病后,首先接受了抗逆转录病毒治疗,1 年后 HIV-1 病毒得到有效控制,并在血清中检测不到病毒 RNA。
随后,研究者从中华骨髓供体库中找到一名 33 岁男性捐赠者的供体细胞,其拥有未突变的 CCR5 基因,且 HLA 配型完全匹配。
利用 CRISPR/Cas9 技术对分离出的 CD34+HSPCs 进行编辑,敲除 CCR5 基因,同时为避免外源 DNA 的引入造成脱靶效应,研究者使用了一种非病毒转染系统来转染 CRISPR/Cas9 系统。
在对病人进行清髓后,将编辑好的同种异体造血干细胞移植进患者体内(由于分选效率限制,其中包括 71.2%已编辑的 CD34+ HSPCs 和另外 28.8% CD34-HSPCs),并辅以抗逆转录病毒治疗、移植物抗宿主病预防用药。
通过对受体骨髓细胞、骨髓成骨细胞 CD34 + 细胞、外周血细胞和外周血 CD4 + 细胞进行 Sanger 测序和深度测序 (3 million reads),评价基因编辑效率。
为了探讨 CRISPR 基因编辑系统可能产生的脱靶效应,研究者又对编辑后和移植后的细胞进行了全基因组测序。
结果显示 CCR5 插入或删除 (indel) 的效率为 17.8%,在移植后 19 个月的时间里,CCR5 突变体在骨髓核细胞中的比例介于 5.20% 和 8.28% 之间。
移植后四周,白血病症状完全缓解,并且 19 个月后期随访没有复发。
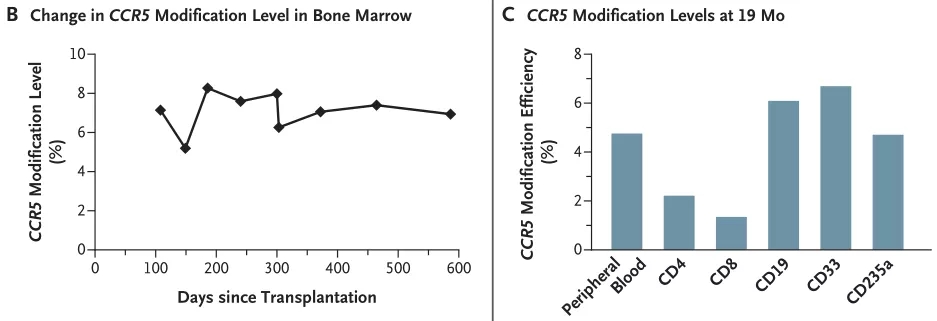
图片来源:NEJM
为了确定 CCR5 编辑的干细胞是否对患者有类似的益处,研究者提出了中断抗逆转录病毒治疗。在获得书面知情同意后病人临时停止了相关抗逆转录病毒治疗。
结果显示,在抗逆转录病毒治疗期间,血清病毒载量在第 4 周增加到每毫升 3×107 拷贝。恢复用药后在接下来的几个月里,病毒载量又逐渐下降到无法检测的水平。
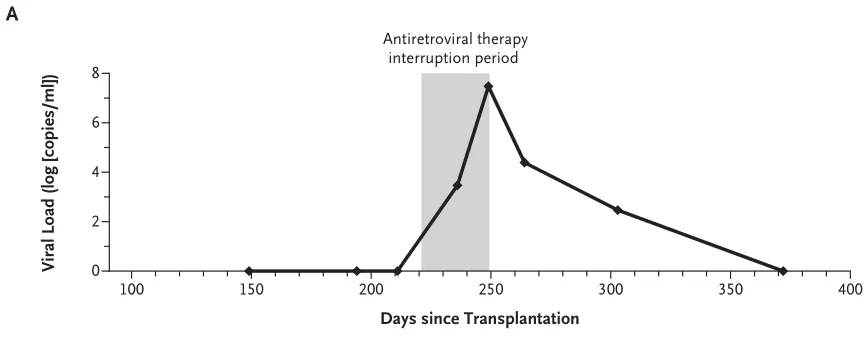
图片来源:NEJM
综上,研究者使用 CRISPR/Cas9 技术对造血干细胞进行基因编辑并移植到患者体内以达到治疗艾滋病和白血病的目的,在安全性上已初步得到验证,并着重强调此次研究遵循了严格的伦理规范,包括取得了受试对象的知情同意。
不过其结果也是喜忧参半,由于其较低的基因编辑效率,使得本研究并未彻底根除 HIV-1 病毒,还需要后续配合抗逆转录病毒药物进行治疗。因此,之后的研究还需对基因编辑的效率进行提高,并且进一步对其治疗的有效性和安全性进行评价。
回顾柏林患者与伦敦患者
2007 年,一个同时患有白血病和艾滋病的「柏林病人」—— 蒂莫西・雷・布朗,在接受具有 CCR5-Δ32 突变的造血干细胞移植后,实现了「功能性治愈」。
科学家们研究发现,布朗的骨髓捐献者先天存在 CCR5 基因突变,而这种变异基因只在少数北欧人体内存在。
此外,在骨髓移植前布朗还接受了放射性治疗,以杀伤被整合了潜伏 HIV 病毒基因的免疫细胞。放射性治疗首先杀死了大量已受到感染的免疫细胞,因而有助于后期移植异体造血干细胞并彻底清除布朗体内的 HIV-1 病毒。
在此后的十多年里,该患者血液中一直未检测出 HIV-1 病毒,证明其艾滋病确实被治愈。
无独有偶,2019 年 3 月 nature 杂志发表一项成果,一名被称为「伦敦患者」的人在 2003 年被查出感染 HIV-1 病毒,2012 年开始接受抗逆转录病毒药物治疗,后又被查出患霍奇金淋巴瘤。
2016 年,该患者接受化学疗法和 CCR5Δ32/Δ32 造血干细胞移植,16 个月后其体内已检测不到 HIV-1 病毒。之后,该「伦敦病人」停止抗逆转录病毒药物治疗,艾滋病缓解已持续 18 个月。
图片来源:央视网
就在今年 10 月 23 日,美国国立卫生研究院(NIH)和比尔及梅琳达・盖茨基金会(Bill&Melinda Gates Foundation)宣布,将在 4 年内各投入至少一亿美元,将最前沿的基因治疗应用到撒哈拉以南的非洲。以期望 10 年内在该地区启动艾滋病和镰状细胞病的基因治疗临床试验。
相信在不远的将来,利用基因编辑技术对人类疾病进行治疗的方法将实现规避伦理及安全问题,并有效地应用于临床治疗领域。