典藏版综述 |「抗艾」四十年,艾滋病治疗的研究现状与挑战
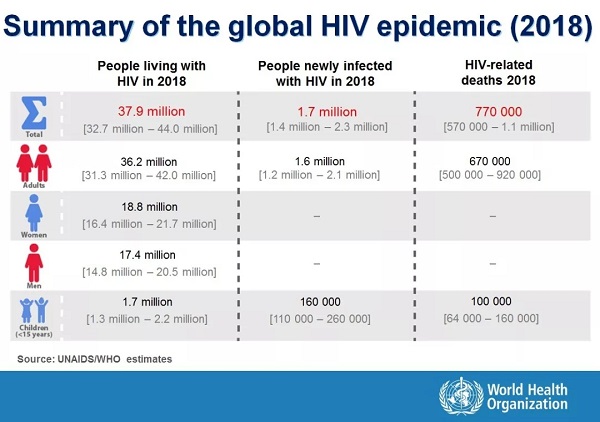
据世界卫生组织报道,截至 2018 年底,全球估计有 3790 万艾滋病毒感染者,与艾滋病相关的死亡人数达到 77 万人。
其中非洲地区受到的影响最大,2018 年有 2570 万艾滋病毒感染者,占到全球艾滋病毒新发感染总数的近三分之二。
图片来源:世界卫生组织官网
艾滋病在中国
1985 年 6 月,北京协和医院首次报告我国境内第一例艾滋病病人,此人为来中国旅游的美籍阿根廷人,发病后 5 天死亡,其并发症状为卡氏肺囊虫肺炎感染。之后的艾滋病病例报告也均是来华外国人和海外华人。
1989 年 8 月,负责云南省艾滋病监测工作的工作人员在瑞丽市戒毒所采得吸毒人员血清 50 份,其中检测发现 HIV 阳性者 26 份。此后,在云南吸毒人群中共发现 HIV 感染者 146 例,这标志着艾滋病已由从国外输入发展到国内传播。
截至 2018 年 9 月 30 日, 全国报告现存活 HIV 感染者/AIDS 病人 85.0 万例, 报告死亡 26.2 万例。

图片来源:中国科学院微生物研究所
HIV 病毒学研究
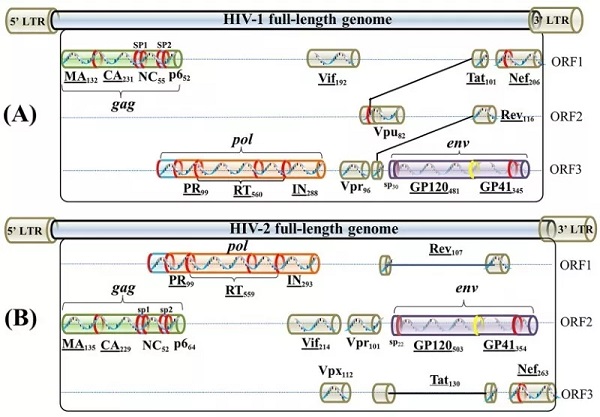
HIV 病毒根据血清学反应和病毒核酸序列可分为两型:HIV- 1 型和 HIV- 2 型。
在 HIV- 1 型内,根据编码包膜蛋白的 env 基因和编码壳蛋白的 gag 基因序列的同源性分为 3 型(M、O、N),M 型又根据膜蛋白基因变化分为 10 个亚型 1。
HIV- 1 的 M 型病毒呈全球性流行,而 HIV- 1 的 O、N 型和 HIV- 2 型仅在非洲局部地区流行。
另外,2019 年 11 月 6 日发表在 Journal of AcquiredImmune Deficiency Syndromes 期刊上的一篇研究 2,雅培公司和密苏里大学的研究人员对来自 45 个国家的 78000 个样本进行分析,发现了一种新型的 HIV 毒株,经鉴定该毒株属于 HIV- 1 M 类亚型 L 型。
图片来源:MICROBIOLOGY ANDMOLECULAR BIOLOGY REVIEWS
抗逆转录病毒药物治疗
目前,针对艾滋病的抗逆转录病毒治疗主要有六大类抗病毒药物分别为:核苷类逆转录抑制剂(NRTI)、非核苷类逆转录酶抑制剂(NNRTI)、蛋白酶抑制剂(PI)、整合酶抑制剂(INSTI)、融合酶抑制剂(FI)、辅助受体拮抗剂(CCR5)。
1996 年美籍华裔科学家何大一提出了高效抗逆转录病毒治疗 (Highly ActiveAnti-Retroviral Therapy, HAART),俗称为「鸡尾酒」疗法。作为人类控制和治疗艾滋病进程中的一个里程碑,这种治疗方式显现出了强大的抗病毒作用。
通过由两种以上抗逆转录病毒药物组成的联合疗法抑制艾滋病毒,虽无法治愈 HIV 病毒感染,但可以很大程度上抑制病毒在人体内的复制,并增强人体免疫系统,恢复其抗感染能力。
但是,尽管 HAART 能够有效抑制 HIV 复制并改善临床结果,由于记忆 CD4 + T 细胞中存在稳定的潜在前病毒库,因此无法治愈病毒感染。
这些细胞可以转录沉默的原病毒,因此设计出诱导病毒基因表达的策略,以便宿主免疫反应可以介导感染细胞的清除或者使细胞经历病毒诱导的细胞死亡,这引起了科学家们的极大兴趣 3。
在世界卫生组织 2016 年版的《使用抗逆转录病毒药物治疗和预防艾滋病毒感染综合指南》中,纳入了新的替代性抗逆转录病毒药物选用方案。
将度鲁特韦(dolutegravir)和低剂量依法韦仑(efavirenz)作为一线疗法,而拉替拉韦(raltegravir)和达芦那韦(darunavir)/利托那韦(ritonavir)作为二线疗法。
这些方案与之前使用的药物相比,具有更好的耐受性、更高的疗效和更低的中断治疗比率。
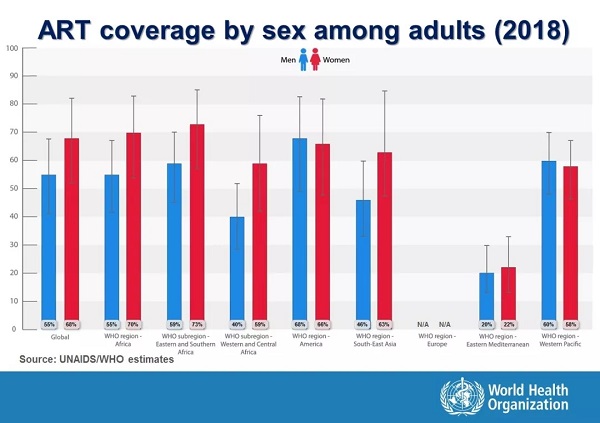
2018 年,全球共有 2330 万 HIV 病毒感染者接受了抗逆转录病毒药物治疗。
同年,抗逆转录病毒药物治疗在全球已覆盖到 62% 的 HIV 病毒感染者。
然而,相比之下只有 54% 的儿童和青少年接受了抗逆转录病毒药物治疗。
图片来源:世界卫生组织官网
HIV 疫苗研发现状
在开发特异性针对 HIV 病毒的疫苗策略上,将能够有效诱导人体产生中和抗体作为疫苗研制的关键部分。
近四十年来人们愕然发现,尽管当天花病毒经疫苗免疫早已被人类消灭,靶向治疗与免疫治疗给肿瘤治疗带来了无限希望,被称为中国「国病」的乙型肝炎也通过疫苗接种得到了有效遏制,但在艾滋病疫苗领域仍然没能取得实质性突破。
究其原因,是 HIV 病毒特有的病毒学性质导致了目前的困境。
首先,HIV 的特殊性在于其只能感染人类,常规的小动物实验模型,如小鼠、兔子等都不太适合用来评价疫苗效果。
尽管早在 1988 年,McCune 等人构建了「人源化」小鼠,即免疫缺陷(SCID)小鼠。但由于其自身免疫系统与人 T/B 淋巴细胞发生相互作用,并且没有繁殖能力需要在每次实验时先进行移植,后续实验效果受移植技术影响很大等原因,尚不适合用来评价药物或疫苗的保护效果。
第二,HIV 病毒的高度变异性也是疫苗研发的一个重要障碍。
HIV 病毒变异的方式主要有两种:抗原漂移和抗原转变,前者是由于 HIV 属 RNA 病毒,其逆转录酶保真性很差,当 RNA 逆转录为 cDNA 时基因组的突变概率可以达到 10 - 5 - 10 - 4。
而抗原转变则是指当两种不同亚型的 HIV- 1 病毒同时感染宿主时,在这个宿主细胞内便会发生病毒基因重组,从而引起大批基因序列的改变。
最后,艾滋病的窗口期(指病毒在人体局部发生感染的这段时间)非常短。相关研究表明清除病毒的最佳时期就在窗口期。
然而,对于 HIV- 1 病毒而言,仅在感染大约 6 天后病毒就会大量复制,然后通过循环系统扩散形成全身感染,因而使得疫苗保护效果并不明显。
同时病毒将自身 RNA 逆转录为 cDNA 与宿主的基因组整合到一起,建立持续性感染也是导致疫苗效果不佳的重要原因 4。
图片来源:Steve Gschmeissner/Science Photo Library
目前,在泰国开展的 RV144 疫苗临床试验是迄今为止唯一显示抗 HIV 感染效果的 HIV 疫苗,虽然在Ⅲ期临床研究中仅仅表现出 31.2% 的保护效率不尽如人意, 但 RV144 仍是目前开发的 HIV 疫苗中唯一一个明确在一定比例的人群中产生有效的免疫保护效果的疫苗。
今年 9 月起,备受瞩目的「马赛克」(mosaic)疫苗 HPX3002 /HVTN706 也将投入 III 期临床试验。
马赛克疫苗是近几年提出的另一设计广谱 HIV 疫苗的新概念。研究人员构建了包括 HIV 的 env 基因和猴免疫缺陷病毒(simianimmunodeficiency virus,SIV)的 gag/pol 基因的双价疫苗。
在恒河猴试验中使 HIV 感染的风险降低 90%,人体测试也有着持久的预防效果,研究人员称其有望使至少 65% 的受试者免于 HIV 感染。
另外,一些新型 HIV 疫苗的研发也给人们带来了希望。
Scott G. Hansen 等 5,开发了一种基于恒河猴巨细胞病毒(RhCMV)疫苗载体的疫苗,成功地清除了 59% 的接种过疫苗的恒河猴体内的猴免疫缺陷病毒。在 12 只接种疫苗的恒河猴中,9 只恒河猴能够在最后一次疫苗接种大约 3 年后严格地控制 SIV 攻击,证实了这种疫苗的持久性效果。
Amelia Escolano 等 6 开发出一种 RC1 免疫原,可辅助识别 HIV- 1 病毒包膜蛋白表面的 V3 -聚糖片段。
用 RC1 对小鼠、兔子和恒河猴进行免疫触发了靶向 V3 -聚糖片段的血清学反应。对抗体克隆和低温电镜结构证实,用 RC1 进行免疫扩大了携带抗 V3 -聚糖片段抗体的 B 细胞克隆,其类似于人广泛中和抗体的前体分子,提示 RC1 可能是一种合适的启动免疫原(priming immunogen)。
近四十年来,进入临床试验的 HIV 疫苗有 100 多种,然而尚无一款有效的 HIV 疫苗投入临床应用,与之相对应的是数以亿计的研发投入资金。
据《2018 年艾滋病预防研究与发展投资报告》(HIV PreventionResearch & Development Investments 2018)显示,2018 年全球各类机构在艾滋病预防研究中总计投资 11.4 亿美元,其中预防性疫苗的研发投资占到 74%,但有效的 HIV 疫苗研发仍然困难重重。其既有病毒自身的原因, 也有思维认识及现有技术手段局限等因素。
因此,大胆尝试新方法新技术, 运用颠覆性科研思维开展 HIV 疫苗研发,或许会给人们带来意想不到的收获 7。

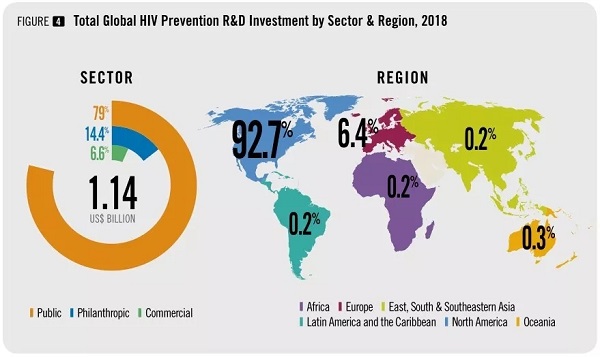
图片来源:AVAC
联合基因编辑的治疗策略
近年来,随着第三代基因编辑技术——CRISPR/Cas 的开发和应用,基因编辑技术开始向着高效性与便捷性发展,并越来越多的应用于精准医疗领域的研究。
而使用以 CRISPR/Cas 技术为代表的基因编辑工具作为人类疾病治疗手段时,往往面临着诸多困难与挑战。比如:
在伦理性上,被改变的基因是否会遗传给下一代?
使用 CRISPR/Cas 技术是否会有大规模脱靶性进而造成致癌风险?
联合 CRISPR/Cas 技术治疗 HIV 感染时是否能有效清除整合的 HIV 病毒 DNA 达到预期治愈效果?
这些都是目前急需进一步评估并解决的问题。8,9
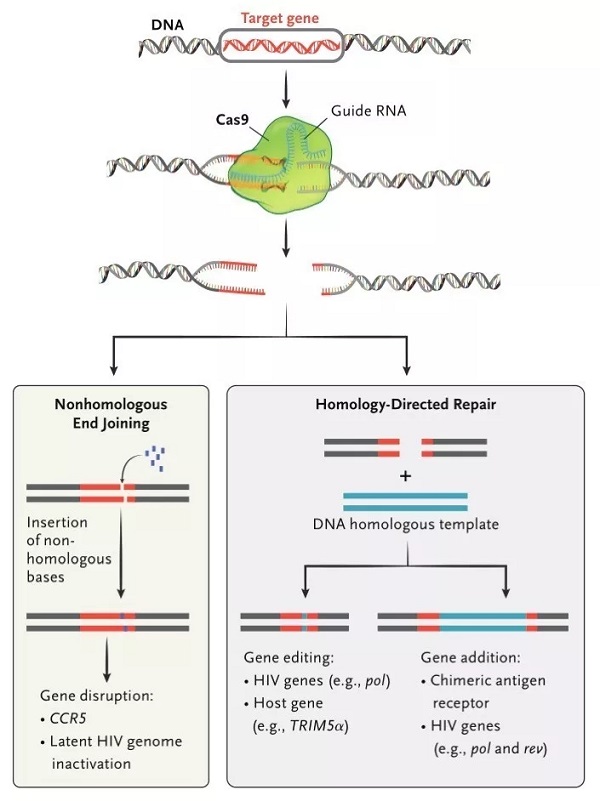
图片来源:The New England Journal of Medicine
2018 年 11 月 26 日,贺建奎团队对外宣布,一对基因编辑 HIV 辅助受体 CCR5 的婴儿诞生,在学术界引发了一次「大地震」。
随后查明,该事件系贺建奎为追逐个人名利,自筹资金,蓄意逃避监管,私自组织有关人员,实施国家明令禁止的以生殖为目的的人类胚胎基因编辑活动。
美国内布拉斯加大学医学中心的 Prasanta Dash 等 10 开发了一种使用纳米颗粒载体递送抗病毒药物并联合 CRISPR/Cas9 技术治疗艾滋病的方法。
小鼠实验表明,接受联合疗法的小鼠中近三分之一没有检测到 HIV 病毒,可认为小鼠细胞和组织里的 HIV 病毒 DNA 被完全消除。
Lei Xu 等 11 在 NEJM 杂志发表论文,公布了世界首例通过 CRISPR/Cas9 基因编辑手段编辑造血干细胞并移植进艾滋病和急性淋巴细胞白血病患者对其进行治疗的案例。
初步证明了基因编辑造血干细胞在临床应用中的可行性与安全性。不过,由于其较低的基因编辑效率,使得本研究并未彻底根除 HIV- 1 病毒。
Chao TC 等 12 发现 HIV- 1 病毒感染与某些 lncRNA 的表达水平存在着显著关系。在一系列验证实验中 HIV- 1 感染 Jurkat T 细胞系和 CD4 + T 细胞后 linc02574 –201 的表达水平显著升高,并将其命名为 HEAL。
随后,研究人员使用了 siRNA 沉默技术以及 CRISPR/Cas9 敲除 HEAL 基因后停止抗逆转录病毒治疗,结果显示 HIV- 1 病毒没有再次出现。
Harald Hartweger 等 13 利用 CRISPR-Cas9 技术对小鼠 B 淋巴细胞进行了基因改造,使得能够产生人 bNAb。在编辑过 B 细胞的野生型小鼠中,用同源抗原进行免疫接种,可产生中和 HIV- 1 的 bNAb 效价,这表明这种技术最终可能用作一种免疫工具。
不过,这种方法可以实现体液免疫反应,而传统的免疫接种可能很难引发此类反应。
未来展望
回顾历史,在人类与艾滋病抗争的近四十年里,虽然投入了大量的资金与人力去攻克这一重大疾病难题,这其中有不少科学家为之贡献一生,也有科学家做出一些有违科学伦理的研究。但是仍然没有开发出对 HIV 感染的有效治愈方法。
笔者认为,近几年随着基因编辑以及 CAR-T 等技术应用于精准医疗领域,在艾滋病的治疗上有了许多不错的成果。但是作为一个感染了几千万人的疾病来说,其尚待进一步评估的安全性和有效性以及高昂的价格,并不能满足全球所有艾滋病患者的需求。最终的治疗方案还是要回到高效抗逆转录病毒药物以及 HIV 疫苗的研发上。
据世界卫生组织统计,截至 2018 年底,估计有 3790 万名艾滋病毒感染者,其中 79% 得到诊断,62% 接受治疗,53% 感染者的艾滋病毒得到抑制,感染他人的风险也较低。
世界卫生组织 2016 年 6 月提出的《2016 - 2021 年全球卫生部门艾滋病毒战略》显示,世卫组织正与各国紧密合作,在五个领域(即战略方向,下图)采取行动,目标到 2030 年终结艾滋病流行这一公共卫生威胁。
让不同年龄段的所有人,不管是儿童还是成人、富人还是穷人、女性还是男性都能过上健康的生活增进人类福祉,对于这一目标我们所有人都充满希望!
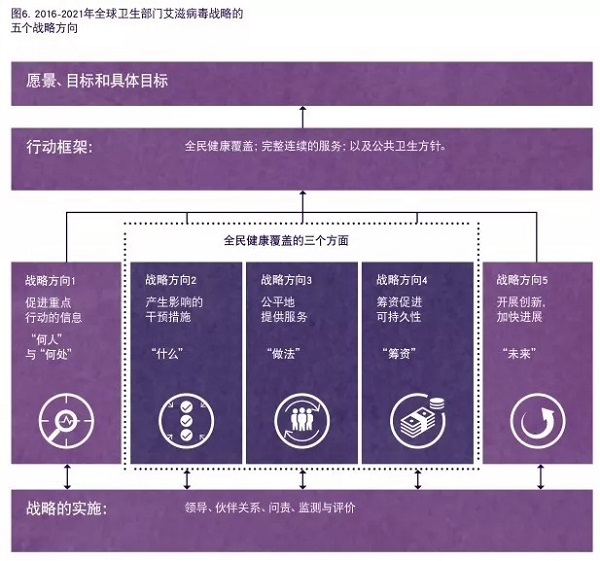
图片来源:世界卫生组织官网
参考文献
1 Li, G. & De Clercq, E. HIVGenome-Wide Protein Associations: a Review of 30 Years of Research. Microbiol Mol Biol Rev 80, 679 - 731, doi:10.1128 /MMBR.00065 - 15(2016).
2 Yamaguchi, J. et al. Complete genome sequence of CG- 0018a- 01 establishes HIV- 1subtype L. Journal of acquired immunedeficiency syndromes (1999), doi:10.1097 /qai.0000000000002246 (2019).
3 Kimata, J. T., Rice, A. P. & Wang,J. Challenges and strategies for the eradication of the HIV reservoir. Curr Opin Immunol 42, 65 - 70, doi:10.1016 /j.coi.2016.05.015 (2016).
4 Burton, D. R. & Hangartner, L.Broadly Neutralizing Antibodies to HIV and Their Role in Vaccine Design. Annu Rev Immunol 34, 635 - 659, doi:10.1146 /annurev-immunol- 041015 - 055515 (2016).
5 Hansen, S. G. et al. A live-attenuated RhCMV/SIV vaccine shows long-termefficacy against heterologous SIV challenge. Sci Transl Med 11,doi:10.1126 /scitranslmed.aaw2607 (2019).
6 Escolano, A. et al. Immunization expands B cells specific to HIV- 1 V3 glycan inmice and macaques. Nature 570, 468 -+,doi:10.1038 /s41586 - 019 - 1250 -z (2019).
7 Tan, S., Shi, Y., Liu, W. J. &Gao, G. F. HIV vaccine development needs unconventional and creative approach. Chinese Science Bulletin 63, 9 - 15, doi:10.1360 /n972017 - 01165(2017).
8 Ebina, H., Misawa, N., Kanemura, Y.& Koyanagi, Y. Harnessing the CRISPR/Cas9 system to disrupt latent HIV- 1provirus. Sci Rep 3, 2510, doi:10.1038 /srep02510 (2013).
9 Carl H. June, M. D. Emerging Use ofCRISPR Technology — Chasing the Elusive HIV Cure. N Engl J Med (2019).
10 Dash, P. K. et al. Sequential LASER ART and CRISPR Treatments Eliminate HIV- 1in a Subset of Infected Humanized Mice. Nat.Commun. 10, 20,doi:10.1038 /s41467 - 019 - 10366 -y (2019).
11 Xu, L. et al. CRISPR-Edited Stem Cells in a Patient with HIV and AcuteLymphocytic Leukemia. N Engl J Med 381, 1240 - 1247, doi:10.1056 /NEJMoa1817426(2019).
12 Chao, T. C. et al. The Long Noncoding RNA HEAL Regulates HIV- 1 Replicationthrough Epigenetic Regulation of the HIV- 1 Promoter. MBio 10,doi:10.1128 /mBio.02016 - 19 (2019).
13 Escolano, A. et al. Immunization expands B cells specific to HIV- 1 V3 glycan inmice and macaques. Nature 570, 468 - 473,doi:10.1038 /s41586 - 019 - 1250 -z (2019).

![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)





