新发现!关键分子 MLLT3 维持造血干细胞的自我更新,体外移植能力可增强 12 倍
造血干细胞,是一种具有自我更新能力及可分化产生红细胞、白细胞、血小板等各种类型的血细胞的干细胞。因此,造血干细胞移植也是目前治疗血液系统恶性疾病最有效的方式之一。
尽管造血干细胞移植的治疗策略已经在过去几十年里挽救了无数生命,但其也有明显的局限性。
首先,找到 HLA 完全匹配的骨髓捐献者很难,而 HLA 不匹配又是发生移植后免疫疾病的重要原因;脐带血移植可在一定程度上缓解 HLA 不匹配的难题,但是脐带血中的较少数量的造血干细是影响移植成功的关键因素。
因此,寻找体外产生或扩增造血干细胞的方法就显得尤为重要。
在过去的数十年中,科学家也做了无数的尝试,例如用多能干细胞或胚胎干细胞诱导分化为造血干细胞,或者利用基因编辑技术改造患者自身的造血干细胞等。
但是,以上尝试都面临一个非常严重的问题:体外培养的造血干细胞很快就会失去自我更新能力或损害其分化为多系血细胞的能力。因此,寻找体外环境中维持造血干细胞自我更新能力的分子就显得尤为重要。
2019 年 11 月 27 日,加州大学洛杉矶分校(UCLA)的 Hanna K. A. Mikkola 团队在 Nature 上以长文的形式发表了题为《MLLT3 governs human haematopoietic stem-cell self-renewal and engraftment》的研究论文。

图片来源:Nature
该研究通过多组学分析筛选出与造血干细胞自我更新能力密切相关的因子 MLLT3,研究人员通过敲减或过表达该基因的方式验证其维持造血干细胞自我更新的功能,并通过移植实验证实了其在维持造血干细自我更新能力方面发挥着关键的作用。
机制层面,他们发现 MLLT3 通过结合转录活性位点及 H3K79me2 发挥其维持造血干细胞自我更新能力的功能。
文章思路及主要内容
为了鉴定维持造血干细胞自我更新的关键分子,研究人员通过分析造血干细胞分化体系、造血干祖细胞培养体系及人胚胎干细胞诱导产生造血干祖细胞体系中下调的基因(下图 a,PS:因为三体系均无法成功扩增造血干细胞),然后从中筛选出 MLLT3。
进一步的分析发现,MLLT3 编码的蛋白在胎儿、新生儿和成人的血液干细胞中非常丰富,但在体外培养体系中却很低。那么该分子是不是维持造血干细胞自我更新能力的关键分子呢?
为了回答上述问题,研究人员通过设计 shRNA 敲减体外培养体系中的 MLLT3,在培养了 30 天之后,他们发现敲减组的造血干祖细胞的数量几乎为 0(下图 b,c)。
同时,通过移植试验发现,在移植 12 周之后,与对照组相比,敲减 MLLT3 组在骨髓中的数量显著降低(下图 e)。但是,过表达 MLLT3 却能够显著增加造血干祖细胞的数量及增强移植后重建能力(下图 f-j)。
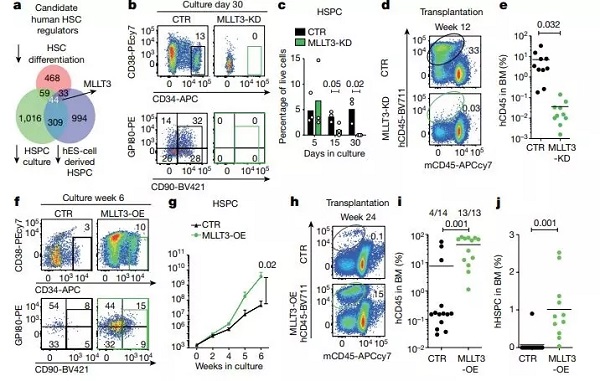
图片来源:Nature
接下来,研究人员探索了 MLLT3 维持造血干细胞自我更新能力的内在机制。
他们通过高通量测序技术--ChIP-seq 找到了 MLLT3 结合的 1579 个位点,并且这些位点绝大部分都分布在转录起始位点( transcription start sites,TSS)5kb 以内(下图 a)。
结合转录组数据发现,在胎肝来源的造血干祖细胞中 MLLT3 结合的基因显著高于未结合的基因,而这些结合的基因多富集在基因表达的调控、造血及转录的相关生物过程上(下图 b, d)。
另外,MLLT3 结合的位点与 H3K79me2、RNA Pol II 结合的模式相似,提示 MLLT3 可能是通过影响 H3K79me2 和 RNA Pol II 来发挥调节目标基因的功能的。

图片来源:Nature
随后,研究人员在体外培养的 FL-HSPCs 中探究持续的 MLLT3 表达是如何调节造血干祖细胞的转录程序。
于是他们对培养了 4 周之后的胎肝来源的造血干祖细胞进行了 ChIP-seq,通过与未培养的细胞相比发现,过表达 MLLT3 后,其结合的位点并未发生明显改变(下图),这提示过表达 MLLT3 并未改变其结合位点,但它是如何发挥调控功能的呢?
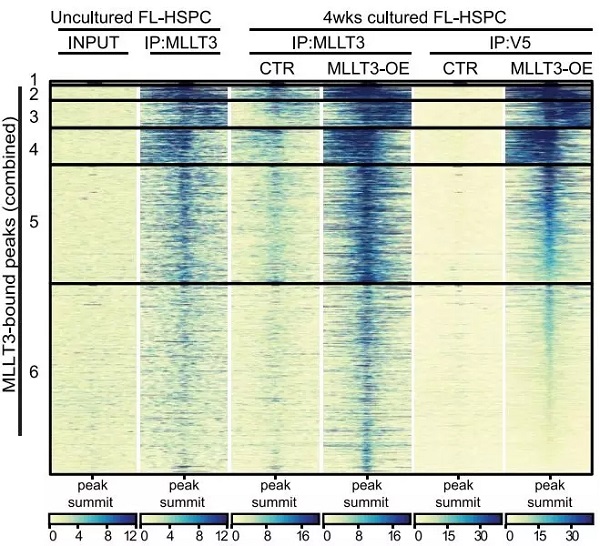
图片来源:Nature
在随后的研究中,他们发现 MLLT3 的过表达尽管没有显著改变其结合位点,但此时细胞的转录组已经发生了明显改变。通过比较分析,他们鉴定出在过表达细胞中 541 个上调和 717 个下调的基因(下图 a, d)。
通过基因富集分析发现,上调的基因多与翻译、糖酵解及造血相关,而下调的基因则和免疫反应及凋亡相关(下图 b)。
这些数据提示 MLLT3 可以通过直接调控与造血干细胞相关的转录因子或者间接通过免疫反应通路发挥功能。
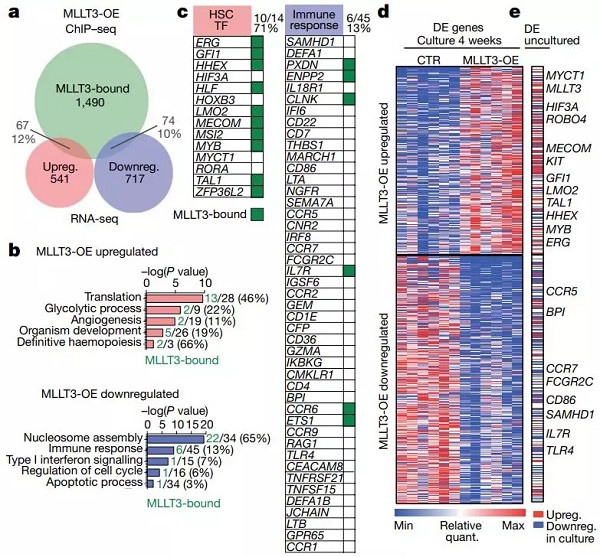
图片来源:Nature
以上的实验及数据均能证明 MLLT3 可以维持造血干祖细胞的自我更新能力及增强移植后重建的能力,并初步探索了其可能是通过组蛋白及 RNA 合成酶来发挥作用的,但是该发现具有怎样的意义或者其实用性是什么呢?
为了回答这个问题,实验人员首先分选脐带血中的造血干祖细胞,对其中一组过表达 MLLT3,并在不同的培养天数后将不同剂量的细胞移植到小鼠体内,观察其重建效率及能力(下图 a)。
首先,研究人员发现过表达 MLLT3 组的总体细胞数量及造血干祖细胞数量均显著高于对照组(下图 b, c),同时,与未培养的细胞相比,体外培养 15 天的 MLLT3 过表达细胞的各系分化能力均无明显差异(下图 d),提示过表达组在保持造血干细胞多系分化能力的前提下提高了其扩增能力。
同时,通过剂量分析发现,过表达 MLLT3 后,培养体系中可移植的功能性造血干细胞至少可以增加 6.8 倍(培养 5 天后)及 12.5 倍(培养 12.5 天后)(下图 f-h)。这种高效率的扩增造血干细胞的体系,在一定程度上能够克服在移植过程中脐带血造血干祖细胞数量不足的难题。

图片来源:Nature
综上所述,该研究通过多组学方法鉴定出维持造血干祖细胞自我更新能力的关键分子 MLLT3,并通过体内外的实验验证了该基因的功能。令人振奋的是,通过过表达该基因,可以使得体外培养体系中可移植的功能性造血干细胞增加 12 倍之多!
文章亮点
1、通过多组学的方法鉴定出造血干细胞自我更新能力的关键分子-MLLT3;
2、MLLT3 以影响组蛋白和 RNA 合成酶来发挥调控作用;
3、该研究中鉴定的 MLLT3 可使体外培养体系中可移植的功能性造血干细胞增加 12 倍之多!
延伸阅读
本文章的通讯作者 Hanna K. A. Mikkola 是国际血液学学会的主席,是血液学领域的领军人物之一,Mikkola 团队在过去的 20 多年里,主要研究在胚胎发育和分化过程中,蛋白质和其他分子是如何影响造血干细胞的。
她希望通过加强对这些过程的理解,以便在实验室中高效、有效地产生功能性、可用于移植治疗的造血干细胞,从而改善白血病和再生障碍性贫血等血液疾病的移植治疗。
2015 年,Mikkola 团队发现一种特殊的蛋白-GPI80,它能够作为标记人体内一种罕见的造血干细胞,并且该蛋白对造血干细胞的自我更新是必须的。该成果发表了国际著名期刊 Cell Stem Cell 杂志。

图片来源:Cell Stem Cell
随后,在 2016 年,Mikkola 团队发现 HOXA 基因簇在造血干细胞的产生和维持方面起着关键作用,并探究了这些基因被激活的过程。该成果发表在 Nature 子刊 Nature Cell Biology 上。

图片来源:Nature Cell Biology
小结
总之,该研究鉴定并证实了 MLLT3 在维持造血干细胞自我更新能力方面发挥着重要的作用,另外 MLLT3 能够使脐带血来源的造血干细胞大量扩增,体外扩增后的造血干细胞,能够在小鼠骨髓内重建造血系统,有效地产生所有类型的血细胞,并保持它们的自我更新能力。
因此,这种体外过表达 MLLT3 的培养体系能够产生足够量的可移植的造血干细胞,为临床治疗血液系统恶性疾病,如白血病、再生障碍性贫血、骨髓增生异常综合征等提供了新的思路。
参考文献:
1. Vincenzo, Calvanese. et al. MLLT3 governs human haematopoietic stem-cell self-renewal and engraftment. Nature (2019)
2. Prashad, S. L. et al. GPI- 80 defines self-renewal ability in hematopoietic stem cells during human development. Cell Stem Cell 16, 80–87 (2014).
3. He, N. et al. Human polymerase-associated factor complex (PAFc) connects the super elongation complex (SEC) to RNA polymerase II on chromatin. Proc. Natl Acad. Sci. USA 108, E636–E645 (2011).
4. Steger, D. J. et al. DOT1L/KMT4 recruitment and H3K79 methylation are ubiquitously coupled with gene transcription in mammalian cells. Mol Cell Biol 28, 2825–2839 (2008).
5. Pina, C., May, G., Soneji, S., Hong, D. & Enver, T. MLLT3 regulates early human erythroid and megakaryocytic cell fate. Cell Stem Cell 2, 264–273 (2008).
6. Sacha Leandra Prashad. et al. GPI- 80 Defines Self-Renewal Ability in Hematopoietic Stem Cells during Human Development. Cell Stem Cell (2015).
7. Diana R. Dou. et al. Medial HOXA genes demarcate haematopoietic stem cell fate during human development. Nature Cell Biology (2016).







