DNA 如何被压缩成染色体?Science 背靠背研究揭示黏连蛋白参与 DNA 环挤压过程
真核细胞中,染色体 (Chromosome) 是在有丝分裂或减数分裂时遗传物质存在的特定形式。
一直以来,我们都知道宏观上动辄 2 米长的基因组 DNA 可以被高度压缩成染色体,可这其中具体是什么样的机制导致了这一事件的发生?使得冗长的 DNA 可以被高度有序压缩而又不会像日常我们用的耳机线一样打结。一直是个未被详细阐明的问题。
过去几十年来,科学家们一直在探讨并提出了环挤压(loop extrusion)模型等不同的假说。
2019 年 12 月 13 日,Yoori Kim 等 1 和 Iain F. Davidson 等 2 在 science 杂志上背靠背发表两篇文章揭示了在存在 NIPBL-MAU2 蛋白复合物的情况下,人黏连蛋白复合物(human cohesin-NIPBL complex)可以充当分子马达的作用在体外高速挤压 DNA 环。
与调节姐妹染色单体内聚的方式不同,黏连蛋白在环挤压过程中不会在拓扑结构上捕获 DNA。这些结果为染色质的环挤压模型提供了直接的证据,并表明基因组结构是高度动态的。

图片来源:science
研究背景
DNA 通过依赖于称为黏连蛋白的环状腺苷三磷酸酶复合物折叠成环状。环状的黏连蛋白复合物既能以拓扑结构也能以非拓扑结构结合染色体,并调节多种染色体生理过程,包括染色体分离,DNA 修复和转录、基因重组等 3。
人黏连蛋白由 SMC1-SMC3 异二聚腺苷三磷酸酶(ATPase)、连接 ATPase 头部的 kleisin 亚基 RAD21 以及螺旋重复蛋白 STAG1/2 组成。
黏连蛋白通过 NIPBL-MAU2 复合物加载到染色体上,其 RAD21 亚基和 NIPBL 的突变会导致人类发育性疾病并伴有多系统功能障碍,统称为黏着病(Cohesinopathy)。
高通量染色体构象捕获(High-throughput chromosome conformation Capture, Hi-C)实验表明,黏连蛋白会通过环挤压过程介导染色体环和拓扑相关域(topologically associated domain, TAD)的形成。
相比之下,黏连蛋白可在体外以不依赖三磷酸腺苷(ATP)的被动扩散形式在 DNA 上滑动,而对于黏连蛋白是否可以通过挤压形成 DNA 环,或者具有使这一过程成为可能的运动活性却仍然是一个悬而未决的问题。
在第一篇研究中,Yoori Kim 等利用单分子成像技术在体外实时观测重组人黏连蛋白,证实人黏连蛋白可以压缩裸露的 DNA 以及结合了核小体的 DNA,并证明了人黏连蛋白通过与 DNA 的非拓扑或伪拓扑相互作用方式介导 DNA 环挤压从而压缩 DNA。
同期发表在 science 上的另一篇文章,Iain F. Davidson 等也有着相似的研究成果。
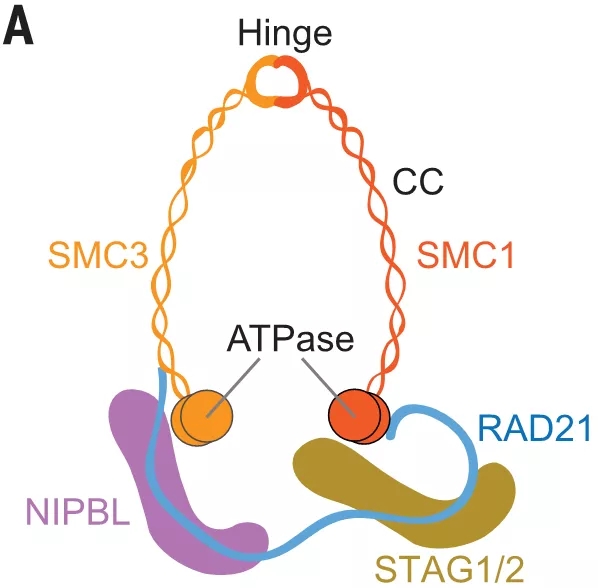
图片来源:science
研究思路
在 Yoori Kim 等的研究中,研究人员首先在昆虫细胞中分别表达和纯化了单独的以及在 C 端结合了 NIPBL(NIPBLC, 残基 1163 至 2804)的重组人黏连蛋白复合物。
体外酶活实验发现,单独的黏连蛋白 ATP 酶活性较低,这一活性会在 NIPBLC 和 DNA 的刺激下大幅升高。而构建的 ATP 酶缺陷型黏连蛋白 SMC1A-E1157Q/SMC3-E1144Q (EQ) 则并无这种特性。
研究人员假设,如果黏连蛋白可以挤压 DNA 环,那么它也可以压缩 DNA。
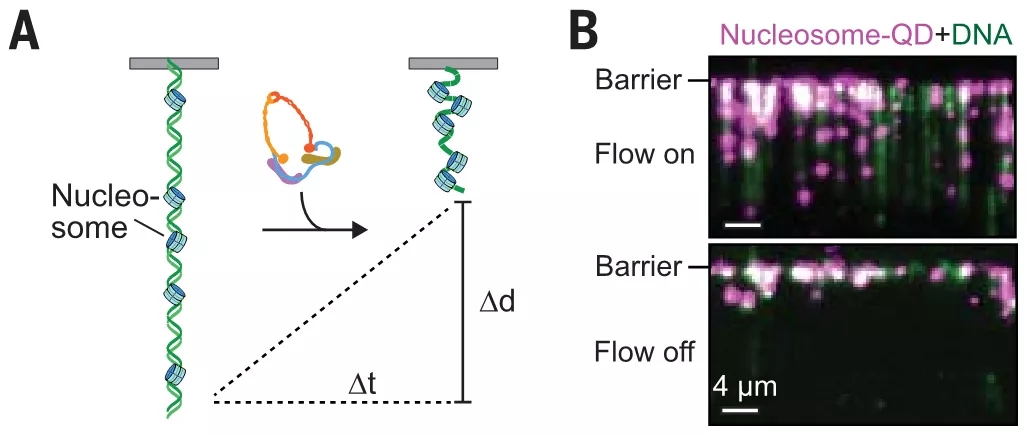
为了证明这一猜想,研究人员使用绿色荧光染料 YOYO-1 对 DNA 进行染色(绿色),量子点(quantum dots, QD)荧光标记黏连蛋白 - NIPBLC 复合物(洋红色),利用全内反射荧光显微镜实时观测固定于脂双层表面的线形 DNA。
结果表明,QD 标记的黏连蛋白 - NIPBLC 复合物一进入流动池便迅速与 DNA 分子结合,在 ATP 的存在下 DNA 高度压缩。
通过改变溶液流速来改变应力,研究人员发现 DNA 压缩速率会随着应力增加而降低,说明 DNA 压缩是力敏感的。
而黏连蛋白 - NIPBLC 复合物在 DNA 底物上的初始结合分布分析表明,其会优先加载到富含 AT 的区域。
单独的黏连蛋白(without NIPBLC)并未发现其结合在 DNA 上,ATP 酶缺陷型黏连蛋白 EQ 则不能在含有 ATP 的情况下结合并压缩 DNA,暗示了依赖黏连蛋白 - NIPBLC 复合物的 DNA 压缩需要 ATP 的参与才能完成。

图片来源:science
为了继续探究黏连蛋白 - NIPBLC 复合物是通过将 DNA 截留在其环腔内来结合 DNA(拓扑结合),还是通过不涉及其环打开而进行的物理相互作用方式结合 DNA(非拓扑结合)。
研究人员发现,拓扑结合的 DNA - 黏连蛋白 - NIPBLC 复合物应具有抗盐性。然而,当注入高盐缓冲液时发现,结合的黏连蛋白脱落,并使 DNA 压缩完全逆转。
因此,能够环状挤压的黏连蛋白 - NIPBLC 可能不会在拓扑结构上与 DNA 结合。
接下来,研究人员又探究了黏连蛋白 - NIPBLC 是否能与结合了核小体的 DNA(Nucleosome-bound DNA)结合并压缩。
研究人员使用盐透析法在每个 DNA 底物上掺入了 1—6 个 QD 标记的人核小体,在多种应力条件下注入未标记的黏连蛋白 - NIPBLC。
结果发现,核小体 - DNA 的压缩程度为大约 80%,平均压缩率为 0.5 kb s-1。核小体结合的 DNA 的压缩也是力敏感的,并且依赖于 ATP 水解。
因此,黏连蛋白 - NIPBLC 压缩核小体结合的 DNA,其性质类似于裸露的 DNA。
另外,之前的研究表明核小体会阻碍了拓扑负载的黏连蛋白的运动,而本次研究发现,黏连蛋白 - NIPBLC 能够以相似的速率压缩裸露的和核小体结合的 DNA,这再次表明,挤压环的黏连蛋白可能没有拓扑结构。
图片来源:science
随后,为了直接可视化黏连蛋白的环挤压过程,研究人员通过将两个 DNA 末端拴在脂双层表面上来制备 U 形 DNA,并实时监控环化事件。黏连蛋白 - NIPBLC 注射后立即形成一个小环并逐渐拉长。
在此过程中,U 形 DNA 的两个臂都发生了压缩。这些结果与黏连蛋白 - NIPBLC 双向挤压 DNA 环的发现相一致,因为单向不对称环挤压预计只会缩短 U 形 DNA 的一个臂。

图片来源:science
最后,研究人员又假设,单个黏连蛋白 - NIPBLC 复合物可以执行对称环挤压,或者两个黏连蛋白 - NIPBLC 协同作用以在两个方向上挤压环。
为了确定有多少黏连蛋白分子执行环挤压,研究人员用 Alexa Fluor 647 染料(Alexa647)直接标记了包含 SNAPf 标记的 STAG1,以可视化黏连蛋白 - NIPBLC 具体位置。并分析了 Alexa647 标记的黏连蛋白 - NIPBLC 在 DNA 环上的光漂白步骤。
在约 50%的 DNA 环上,研究人员观察到两个荧光焦点,每个焦点分别在环的基部和尖端。两个 Alexa647-cohesin 焦点的光漂白步骤数均达到两个峰值,而对于光漂白步骤的数目,未形成环的 DNA 上的黏连蛋白焦点并没有离散的峰。
因此,环挤压复合物应包含两个黏连蛋白分子。这些数据表明,黏连蛋白 - NIPBLC 二聚体可能是 DNA 环挤压的最小功能单元。

图片来源:science
延伸阅读
早在三十多年前遗传学家们就知道,基因组会形成环状结构,从而拉近调控元件与所控制的基因,但是还不清楚这些环是如何形成的。
这些年来,数名研究人员分别独立提出了环挤压的模型。
第一位是位于加利福尼亚州贝克曼研究所的遗传学家 Arthur Riggs,他在 1990 年的一份被忽略的报告中首次提出了他所谓的「DNA 绕线法」(DNA reeling)4。

图片来源:PHILOSOPHICAL TRANSACTIONS OF THE ROYAL SOCIETY B
而在基因组 3D 结构研究爆炸式发展的当代,Mirny 提出的环挤压模型 5,让这些假说在分子细节层面上升到了新的高度。

图片来源:Proc Math Phys Eng Sci
小结
总的来说,本次 Science 的两篇研究结果支持了黏连蛋白 - NIPBLC 二聚体在两个方向上对称地挤压 DNA 环的模型。双向环挤压也解释了观察和模拟的染色体环 Hi-C 图。
重组人黏连蛋白 - NIPBLC 在相对较低的作用力和较低的盐浓度下进行环挤压, MAU2 和 NIPBL 的 N 端区域和其他黏连蛋白互作因子进一步稳定了黏连蛋白在 DNA 上的结合,并增强其在细胞中的固有环挤压活性。
高盐缓冲液从 DNA 中去除了环挤压黏连蛋白。最后,核小体不会阻碍黏连蛋白 - NIPBLC 介导的 DNA 压缩。
这些发现表明,黏连蛋白 - NIPBLC 复合物在 ATP 的存在下通过与 DNA 的非拓扑或伪拓扑相互作用介导环挤压并压缩 DNA。
尽管基因组成环会调控基因表达是日益明确的事实,比如,笔者在上周也对今年 9 月份和 10 月份发表在 nature 杂志上的两篇关于 B 细胞如何产生抗体的文章做了解读,其中 B 细胞产生抗体时发生的 V (D) J 重排和抗体类别转换同样也是依赖于 DNA 的环挤压机制。(详情可戳:B 细胞内抗体产生新机制!两篇 Nature 重磅揭示染色质环挤压导致 V(D)J 重组和抗体类别转换重组)
除此之外,DNA 环挤压也可能与细胞发育和癌症等疾病相关,不过这些模型的预测也超出了现有的实验观测手段的范围,因此基于 DNA 环挤压而导致的各项生理机制还需要更深一步的挖掘与重视。
参考文献
1. Y. Kim, Z. Shi, H. Zhang, I. J. Finkelstein, H. Yu, Human cohesin compacts DNA by loop extrusion. Science 366, 1345-1349 (2019).
2. I. F. Davidson et al., DNA loop extrusion by human cohesin. Science 366, 1338-1345 (2019).
3. J. H. Haarhuis, A. M. Elbatsh, B. D. Rowland, Cohesin and its regulation: on the logic of X-shaped chromosomes. Dev Cell 31, 7-18 (2014).
4. A. D. Riggs, DNA Methylation And Late Replication Probably Aid Cell Memory, And Type-I DNA Reeling Could Aid Chromosome Folding And Enhancer Function. Philos T R Soc B 326, 285-297 (1990).
5. C. A. Daily-Diamond, C. E. Gregg, O. M. O'Reilly, The roles of impact and inertia in the failure of a shoelace knot. Proc Math Phys Eng Sci 473, 20160770 (2017).


![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)




