许石正丽的这篇综述可以解释:为什么每次冠状病毒疫情都会打得我们措手不及?
随着新型冠状病毒的传播,到目前为止已造成近七万人感染,在全国造成严重疫情并蔓延至世界其他国家。
冠状病毒可引起人和动物的呼吸道和肠道感染,由于在人类中传播的大部分冠状病毒主要在健康人群身上引起轻度感染。直到 2003 年爆发的严重急性呼吸系统综合症 (SARS),它们才被认为对人类具有高致病性。SARS 之后,2012 年中东呼吸综合征冠状病毒 (MERS- CoV) 在中东国家爆发;2016 年广东省 4 个养猪场观察到猪急性腹泻综合征 (SADS);2019 年底,武汉爆发的新型冠状病毒(SARS-Cov-2),短时间内在国内造成严重疫情。回顾历次冠状病毒疫情,广泛的流行病学调查以及对冠状病毒起源和演变的认知,使我们对冠状病毒有了更深的了解。不断地变异和重组使其爆发似乎在意料之中,然而每次疫情的严重性却常在科研人员以及政府管理部门意料之外!究其原因,是否我们对冠状病毒的重视程度还不够?图片来源:美国国家过敏与传染病研究所
2019 年 3 月,中科院武汉病毒研究所石正丽研究员在 Nature Reviews 发表综述文章《Origin and evolution of pathogenic coronaviruses》,详细总结了目前关于 SARS、MERS 这两种致病性冠状病毒的起源和演变的知识,并讨论了它们的受体用法。同时还强调了蝙蝠传播的冠状病毒的多样性和跨物种传播潜力。1以下,笔者根据该文章,为大家详细解读目前熟知的冠状病毒起源和演化知识,同时探讨为什么每一次冠状病毒疫情爆发都会让我们不知所措?图片来源:Nature Reviews
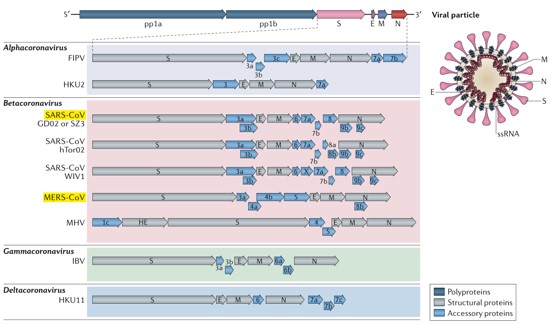
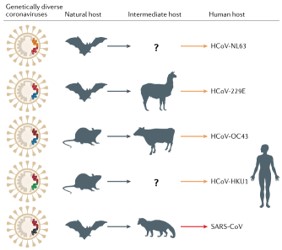
1937 年,冠状病毒(Coronaviruses)首先从鸡身上分离出来。1965 年首次分离出第一株人冠状病毒。由于在电子显微镜下观察到其形态像帝王的皇冠,因此命名为「冠状病毒」。在系统分类上,冠状病毒属冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus),是具外膜 (envelope) 的正链单股 RNA 病毒。根据基因组结构,该亚科由四属组成,分别为 α 冠状病毒病毒、β 冠状病毒、γ 冠状病毒和 δ 冠状病毒,其中 α、β 冠状病毒只感染哺乳动物。γ 和 δ 冠状病毒感染鸟类,其中一些也能感染哺乳动物。α、β 冠状病毒通常会引起人类的呼吸道疾病和动物肠胃炎等疾病。到目前为止,一共发现 3 种高致病性病毒:SARS-CoV、MERS-CoV 以及 SARS-CoV- 2 引起人类严重呼吸道综合征,此外其他 4 种人类冠状病毒:HCoV- NL63, HCoV- 229E, HCoV- OC43 以及 HKU1 只会在健康人群中引起轻微的上呼吸道疾病 2。根据目前的序列数据库,所有人类冠状病毒均起源于动物。其中 SARS-CoV、MERS-CoV、HCoV-NL63 和 HCoV- 229e 被认为起源于蝙蝠;HCoV- OC43 和 HKU1 来源于啮齿动物。根据过往发生的疫情判断,家畜和野生动物也可作为中间宿主,使病毒能够从自然宿主传播到人类。图片来源:Nature Reviews
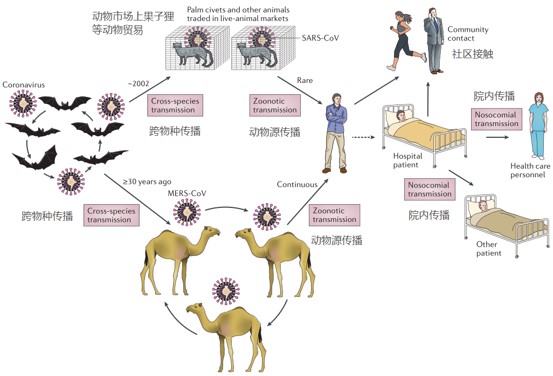
在 SARS 流行初期,几乎所有的早期患者在发病前都有过动物接触。在确定了 SARS-CoV 病原体之后,研究人员又在果子狸和动物饲养员身上发现了 SARS-CoV 和 / 或抗 SARS-CoV 抗体。然而,后来对饲养和野生的果子狸进行的广泛调查显示,市场果子狸身上发现的 SARS- CoV 毒株是由马蹄形蝙蝠传染给它们的。之后,在中国以及欧洲、非洲和东南亚的蝙蝠中也都发现了许多与 SARS- CoV 有亲缘关系的冠状病毒 (SARSr-CoVs)。之前的研究发现,果子狸体内 SARS-CoV 与人体内 SARS-CoV 的基因组序列几乎完全相同。然而,其中的 orf8 基因和 S 基表现出主要的变异 3。SARS-CoV 的 S 蛋白功能上分为两个亚基:S1 和 S2,分别负责受体与细胞膜的结合和融合。其受体结合域(receptor- binding domain, RBD)中的两个氨基酸残基 (479 和 487) 被认为是 ACE2 介导的 SARS-CoV 感染的关键,也是病毒从果子狸传播给人类的关键。经过 16 年的研究,科学家在中国云南省的一个洞穴中发现,蝙蝠种群中存在高度多样化的 SARSr-CoVs。此外,还发现存在于这一地区的病毒株包含形成 SARS-CoV 所需的所有遗传因素。不过,科学家并未在蝙蝠种群中发现 SARS-CoV 的直系祖先,重组分析也表明果子狸 SARS-CoV 株 SZ3 是通过重组现有的两种蝙蝠毒株 WIV16 和 Rf4092 而产生的 4。图片来源:Nature Reviews
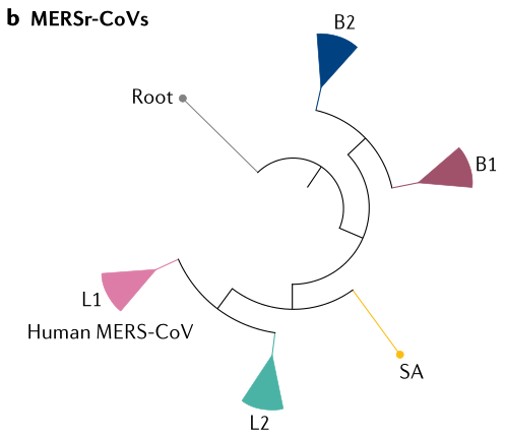
由于在 SARS 爆发期间云南省没有 SARS 病例,因此,2002 - 2003 年的 SARS 极有可能是其直接祖先首先由蝙蝠体内重组产生,然后传播给饲养的果子狸或另一种哺乳动物,再在果子狸之间通过粪口传播。当感染病毒的果子狸被运送到广东市场时,病毒在果子狸市场中传播,并在扩散到人类之前获得进一步变异。考虑到蝙蝠 SARSr- CoVs 的流行和巨大的遗传多样性,它们的密切共存以及冠状病毒的频繁结合,未来出现新的变异也是意料之中的事件。MERS(Middle East Respiratory Syndrome) 病毒最早于 2012 年 9 月在沙特被发现,早期因与 SARS 临床症状相似得名「类 SARS 病毒」,也成为第 6 种已知的人类冠状病毒。与以 ACE2 作为受体的 SARS-CoV 不同,MERS-CoV 使用双肽肽酶 4 (DPP4,也被称为 CD26) 作为细胞进入受体。大多数早期 MERS 病例与单峰骆驼有过接触。1983 年采集的骆驼血清样本中检测到 MERS-CoV 感染,这表明至少 30 年前就有 MERS-CoV 存在于骆驼体内。基因组序列分析表明 MERS-CoV 与 HKU4 、HKU5 具有亲缘关系 (β 冠状病毒谱系 C)。该谱系中的病毒具有独特的基因组结构,其多聚蛋白和大多数结构蛋白高度保守,但其 S 蛋白和附属蛋白却高度可变。大量的重组分析表明,MERS-CoV 起源于不同病毒祖先之间遗传元素的交换,其中也包括那些从骆驼和蝙蝠身上分离出来的病毒。然而,考虑到蝙蝠 MERSr-CoVs 与人类和骆驼 MERS-CoVs 之间的系统发育差异,应该还存在其他在自然界中传播并直接导致人类和骆驼出现 MERS-CoV 的尚未被识别的病毒。图片来源:Nature Reviews
从人和骆驼身上分离的 MERS-CoVs 全长基因组序列几乎一致 (>99%)。其主要的变异发生在 S、ORF4b 和 ORF3 基因中。而蝙蝠的 MERSr-CoVs 与人类和骆驼的 MERSr-CoVs 在基因组序列上却存在很大差异,一致性最高约为 85%。与人类和骆驼的 MERS-CoV 相比,蝙蝠 MERSr-CoVs 的 S 蛋白序列一致性约为 45 - 65%,在 RBD 区域的序列一致性更低。另外,包括 ORF3、ORF4a、ORF4b 和 ORF5 编码在内的基因在蝙蝠 MERSr-CoVs 与人类和骆驼的 MERSr-CoVs 之间在长度和序列上也有很大的差异。总的来说,以上的发现表明这些基因在其自然宿主中发生了实质性的进化。图片来源:Nature Reviews
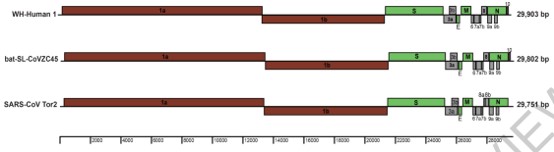
自 2019 年 12 月以来,新型冠状病毒 SARS-CoV- 2 已对我国乃至世界的公共卫生构成了重大威胁。根据 2 月 3 日发表在 Nature 上的一篇论文 5,来自上海公共卫生临床中心、复旦大学公共卫生学院张永振团队利用该病毒(文中名称为 WH-Human- 1 coronavirus)的基因序列进行系统发育分析表明,该病毒与一组蝙蝠来源的 SARS 样冠状病毒的亲缘关系最为密切,其核苷酸相似性达到了 89.1%,并且与 SARS-CoV 类似,都是以 ACE2 为细胞进入受体。之后在 2 月 4 日,意大利博洛尼亚大学的研究人员鉴定了特定的蝙蝠冠状病毒与 SARS-CoV- 2 冠状病毒的基因组,系统生物学分析发现 SARS-CoV- 2 与蝙蝠冠状病毒的蛋白质序列同一性为 91.1%,为 SARS-CoV- 2 的人畜共患病起源提供了进一步的证据。2 月 6 日,华南农业大学发现穿山甲为新型冠状病毒潜在中间宿主,该研究团队分析了上 1000 份宏基因组样品,通过分子生物学检测,发现穿山甲中 β 冠状病毒的阳性率为 70%。进一步对病毒进行分离鉴定,通过病毒基因组分析,研究人员发现,分离的病毒株与目前感染人的毒株序列相似度高达 99%。此外,自张永振教授团队的研究中,研究人员使用重组检测程序对 SARS-CoV- 2 的全基因组序列和四种代表性冠状病毒:Rp3、CoVZC45、CoVZXC21 和 SARS-CoV Tor2 进行了分析。发现了在 SARS-CoV- 2 与 SARS-CoV Tor2 和 Rp3 的 S 基因中一些过去重组的证据。研究人员表示,尽管重组事件在冠状病毒中比较常见,但没有直接证据表明这些重组促进了 SARS-CoV- 2 的出现。图片来源:Nature
因此,根据目前为止的研究数据分析,笔者假设此次的 SARS-CoV- 2 也不排除是蝙蝠 SARS-CoV 相关的冠状病毒在发生重组后通过中间宿主传播并进一步发生变异,最终导致在人类之间广泛传播的可能性。近几十年来,虽然人类早已通过疫苗战胜了天花病毒,但是随后而来的如 HIV、埃博拉、寨卡、SARS-CoV、MER-CoV 以及如今的新型冠状病毒,无一不让人类社会遭受严重打击。近日,迄今为止规模最大、最有希望的 HIV 疫苗项目也宣布彻底失败 6。以上,究其原因或许我们对于病原体尤其是造成突发疫情的病毒还认识不够,甚至对于冠状病毒这类还没有引起足够高的重视!SARS 以前,人们对冠状病毒的研究兴趣不大,资金也很少。直到后来 SARS 疫情的爆发,政府大量设备资金的投入,科学家开始不分昼夜地研发特效药和疫苗。然而,过了半年,SARS 疫情结束,已找不到合适的患者参与临床实验,疫苗的研制也停滞不前。迄今为止,全世界还没有任何一款上市的冠状病毒疫苗。药物和疫苗研发从来都不是那么容易的,一种新药的诞生往往需要经过实验室阶段、动物实验、临床三期实验还要通过各项审批才能成功上市,前后花费至少十年时间和大量的资金投入。不过,值得庆幸的是,随着世界尤其是中国科研实力的大幅提高,我们在应对突发疫情时已不再像应对 SARS 时那么不知所措了。2 月 15 日,在国务院联防联控机制举行的发布会上。中国科学院微生物研究所严景华研究员表示,「新冠病毒来了以后,我们很快把这个策略和方法用在新冠病毒疫苗的设计,目前我们已经设计完成了这个疫苗,现在已经在动物体内进行测试,看看免疫效果,还要进行安全性评价。」她表示,为争取疫苗早日上市,科研人员把研发周期变成并联的方式,很多试验在同步推进。图片来源:央视新闻
2 月 14 日下午,习近平在主持召开中央全面深化改革委员会第十二次会议上也强调,要把生物安全纳入国家安全体系,尽快推动生物安全法。指出这次抗击新冠肺炎疫情,是对国家治理体系和治理能力的一次大考。要研究和加强疫情防控工作,从体制机制上创新和完善重大疫情防控举措,健全国家公共卫生应急管理体系,提高应对突发重大公共卫生事件的能力水平。图片来源:央视新闻
此次的疫情,从一个方面来说既是天灾也是人祸。疫情开始阶段防控措施不到位,疫情期间,各地因抗疫不力被问责或者免职的卫健系统官员,则大多数不具备医疗或者卫生管理专业背景。这也侧面反映出了当前卫健系统中,专业管理型人才的严重不足,以及管理岗位选才用人的问题。相信这一次的疫情也将会给我们的政府部门和科研机构带来一些总结和思考,努力健全国家公共卫生应急管理体系。在机制保障上,给专业疾控机构充分赋权,简化行政审批,完善立法,健全针对重大突发性传染疾病的联动响应机制,并设立危机应对的常备队伍。在国民教育层面,加大健康教育和全民疾病科普,用实际行动提升人民对政府和科研机构的信任。
参考文献
1 Cui, J., Li, F. & Shi, Z.-L. Origin and evolution of pathogenic coronaviruses. Nature Reviews Microbiology 17, 181 - 192, doi:10.1038 /s41579 - 018 - 0118 - 9 (2018).
![]()