颠覆教科书!首个无需进行呼吸作用的多细胞动物,打破生命探索固有模式!
线粒体的获得是真核生物进化中的一个关键事件。线粒体拥有自身的遗传物质和遗传体系,但其基因组大小有限,是一种半自主细胞器。此前,广为接受的观点是,现存的多细胞真核生物在没有氧气的情况下是无法生存的。
2 月 24 日,PNAS 刊出了以色列特拉维夫大学的研究人员题为《A cnidarian parasite of salmon (Myxozoa: Henneguya) lacks a mitochondrial genome》的一项颠覆性的发现,他们通过深度测序以及显微镜观察表明 Henneguya salminicola(鲑居尾孢虫)已经失去了线粒体基因组以及几乎所有参与线粒体基因组转录和复制的核基因,这是已知的首个没有线粒体基因组的多细胞生物。

图片来源:PNAS
粘原虫类(Myxozoan)寄生虫是一类神秘的刺胞寄生虫,具有复杂的生命周期,其需要两个宿主,通常是鱼和一种小型动物。它们会对渔业和水产养殖业产生重大的负面经济影响。粘原虫线粒体一般具有高度发散的基因组结构,具有大的环状染色体和异常高的进化率。
为了进一步深入了解了粘原虫线粒体基因组的进化,作者研究了两个密切相关的淡水粘原虫物种,Henneguya salminicola 和 Myxobolus squamalis。它们都是鲑鱼的寄生虫,与珊瑚虫、水母和海葵属于同一门,当鲑鱼吃了含有这些寄生虫的蠕虫时,这种寄生虫就会进入鲑鱼的肌肉中。在鱼体内,这些寄生虫看起来就像是从肌肉组织中渗出的白色气泡。

真核生物的系统发育关系
图片来源:PNAS
线粒体基因组分析揭示两种寄生虫之间存在的显着差异
作者复原了 M. squamalis 由单个染色体组成的环状线粒体基因组。与其他黏附寄生虫类似,M. squamalis 线粒体基因组缺乏 tRNA 基因,并且进化速度快。与之对比鲜明的是,作者无法在 H. salminicola 中鉴定任何线粒体序列,尽管该基因组的质量比 M. squamalis 高。

粘原虫线粒体基因组的存在情况、核编码线粒体基因的数量
图片来源:PNAS
为了鉴定在粘原虫线粒体中是否存在 DNA,作者用 DAPI 对不同发育阶段的 M. squamalis 和 H. salminicola 多细胞体进行了染色。M. squamalis 的细胞显示出真核细胞核染色和线粒体的特征性染色(更小的蓝点),而 H. salminicola 仅显示出核染色,显微镜检查结果以及基因组和转录组装配中缺少线粒体,支持了作者的假说,即该 H. salminicola 失去了线粒体基因组。
电子显微镜图像显示 H. salminicola 和 M. squamalis 双膜细胞器线粒体与嵴,在这两个物种的基因组中也检测到参与嵴组织的基因,如 DNAJC11。这些结果证实,H. salminicola 中存在没有线粒体基因组但有类线粒体的细胞器(MRO)。
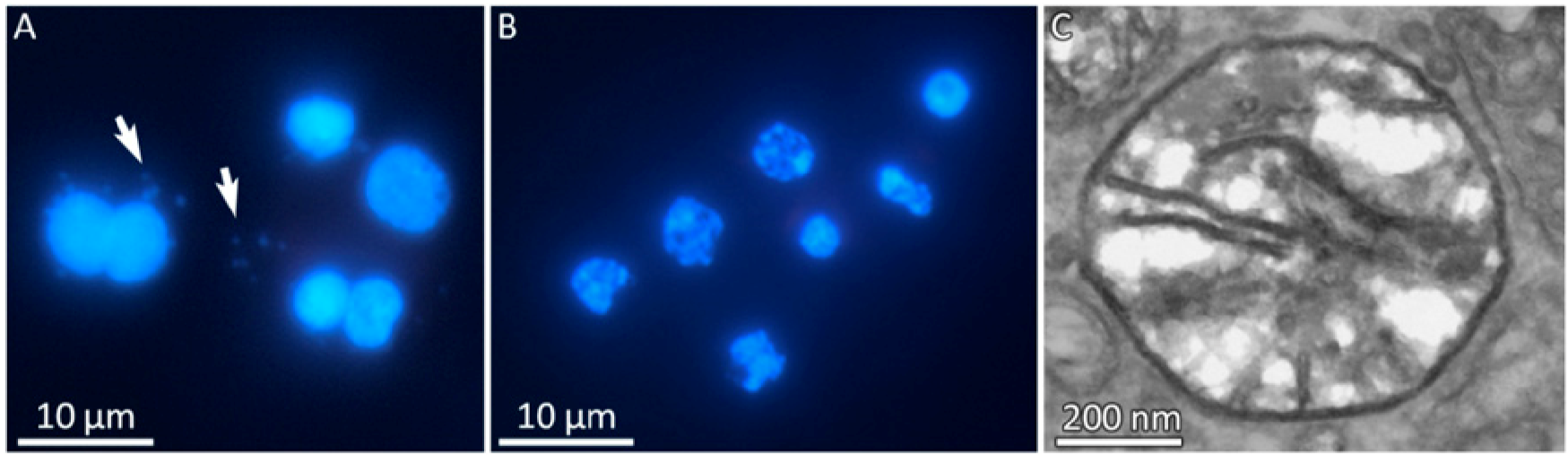
H. salminicola 中没有线粒体的微观证据
图片来源:PNAS
参与线粒体基因组转录和复制的核基因的丢失
细胞核编码大多数线粒体蛋白质组,作者分别在 H. salminicola 和 M. squamalis 中鉴定出了与关键线粒体代谢途径(例如氨基酸,碳水化合物或核苷酸代谢)有关的各 51 和 57 个基因。这表明 H. salminicola 的 MRO 类似于 M. squamalis 的线粒体且仍具有多种代谢功能。
但是 H. salminicola 的基因组中几乎没有涉及线粒体基因组复制和翻译的所有核编码蛋白。使用核编码基因的数据库进行比对,作者发现 M. squamalis 有 41 至 58 个核编码的线粒体同源基因 ,但 H. salminicola 只有这些基因中的 6 个。此外,作者计算出 H. salminicola 的进化速率没有其他粘原虫类寄生虫快,而过快的进化速率可能会阻碍基因发现。
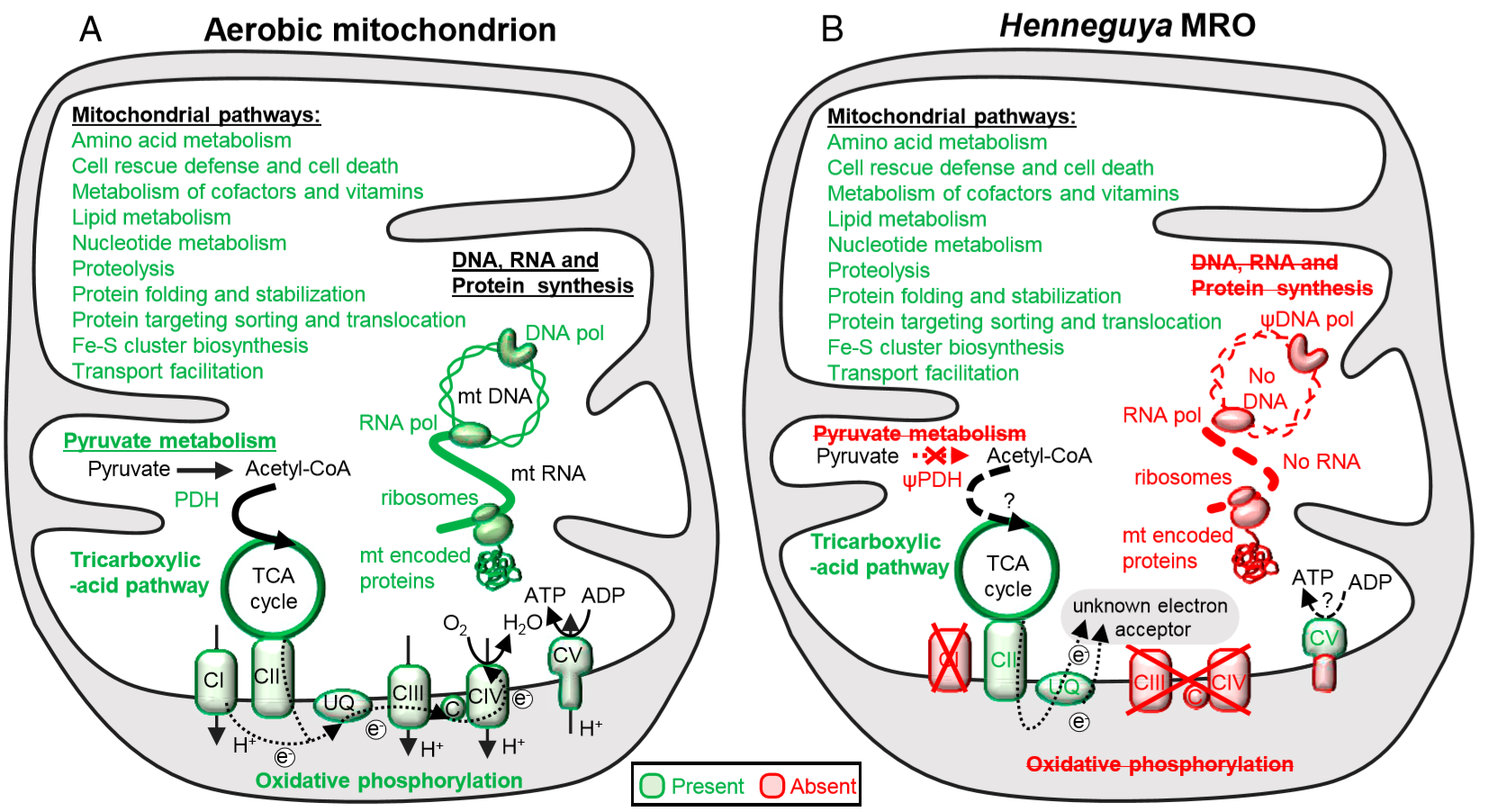

上:典型的有氧呼吸线粒体(A)和 H. salminicola 的 MRO(B)中代谢途径之间的比较
下:存在于特定物种中的线粒体 / MRO 途径,以及线粒体基因组存在情况
图片来源:PNAS
有趣的是,在 H. salminicola 中编码线粒体 DNA 聚合酶亚基的基因是假基因,其包含三个点突变,产生了过早的终止密码子(移码突变)。此外,该基因在 H. salminicola 中不表达,在 H. salminicola 转录组中不存在,而作者在所有其他粘原虫转录组中都鉴定到了同源基因。
该聚合酶假基因的存在支持了作者的主要结论,即 H. salminicola 由于没有完好的线粒体 DNA 复制机制,已经失去了线粒体 DNA;其次,它表明该物种中蛋白质同源物的缺失是假基因化的结果,而不是组装错误造成的假象。
线粒体基因组的丢失会影响有氧呼吸,因为动物的线粒体基因组会编码电子传输链的必需蛋白。为了验证线粒体基因组的丧失是否意味着 H. salminicola 丧失了有氧呼吸作用,作者搜索了通常编码约 100 种蛋白的已知线粒体电子传输链复合物同源基因,发现只有 7 个编码线粒体蛋白的核基因保留在 H. salminicola 的基因组中,而其他粘原虫中则有 18 至 25 个。
在其他粘原虫中识别出了将质子泵入线粒体膜间空间的复合体 I、III 和 IV 的基因,其在 H. salminicola 中不存在,或者呈现为假基因。而复合物 IV 与氧气分子相互作用,因此,H. salminicola 可能无法进行有氧呼吸。
在其他粘原虫中也存在编码三磷酸腺苷(ATP)合酶复合物的 Fo 亚基的基因(即质子通道),但其在 H. salminicola 中的缺失表明,在 H. salminicola 的内细胞器膜上不存在质子梯度。然而,H. salminicola 编码复合体 II(属于 TCA 循环的一部分)以及 ATP 合酶的 F1 亚基的基因数量与其他粘原虫寄生虫相似。
讨论
从结构上看,H. salminicola 丢失了其线粒体基因组,但保留了类线粒体的细胞器(MRO),MRO 经常丢失相同的线粒体途径(例如,丙酮酸脱氢酶或电子传输链酶)。在某些情况下,可以通过水平基因转移获得氢化酶或丙酮酸甲酸盐裂解酶(可通过厌氧丙酮酸代谢和氢气合成产生 ATP)的同源基因,具有这种新代谢的线粒体被称为氢化酶体(hydrogenosomes),但是 H. salminicola 基因组不包含任何氢化酶基因,因此 H. salminicola 中的 MRO 并非氢化酶体。
在 H. salminicola 存在嵴(由膜的内陷形成),而这些嵴通常在厌氧代谢的 MRO 中是不存在的。H. salminicola 的 MRO 失去了复合物 I,III 和 IV,但拥有另一种氧化酶并保留了嵴。这表明,线粒体 DNA 的缺失和有氧呼吸可能是 Henneguya 谱系中最近的进化事件。需要进一步的实验,以更好地表征 H. salminicola 的代谢能量途径,但是目前还不能在实验室中培养 H. salminicola。
与大多数粘原虫相似,H. salminicola 可能在两个寄主之间轮换跳跃。H. salminicola 在其鱼类寄主白肌内的假性囊肿中经历增殖和孢子形成阶段(白肌是一种具有厌氧代谢的组织)。由于所有丢失其线粒体基因组的生物都生活在厌氧环境中,因此推测 H. salminicola 中线粒体基因组的丢失都是由宿主中的低氧环境驱动的。
多余的基因的丢失可能赋予了进化上的优势,在小型基因组中,基因的生物能成本是比较高的。粘原虫具有更小的基因组(22 - 180 MB)比自由生活的刺胞寄生虫门(> 250 MB)。因此,丢失涉及电子途径和复制的线粒体基因组和相关核基因的对于生活在厌氧环境中的粘原虫可能是有利的,让它能尽可能快且频繁地繁殖。但是不能排除由于随机漂移造成的无用基因的损失。作者的结果也为针对这种病原体的新治疗方法开辟了道路,因为已知厌氧生物对特定药物敏感。
粘原虫在适应过程中经历了特别的形态和基因组简化。值得注意的是,这些粘原虫寄生虫的基因组简化似乎不是在祖先中发生的,而是次生损失的结果。粘原虫作为生活在海洋、淡水甚至陆地环境中的高度多样性的物种群体,进化中的基因丢失和简化显然是一种成功策略。
该研究发现也证实了对厌氧环境的适应并非单细胞真核生物独有,而是在多细胞寄生寄生虫中也得到了进化。因此,该研究为了解从有氧代谢到无氧代谢的进化过渡提供了机会。
鲑居尾孢虫如何在不呼吸的情况下获取所需能量仍是未解之谜,它很可能从宿主身上获取能量,但要进一步研究才能获得答案。
原文链接:
https://www.pnas.org/content/early/2020/02/18/1909907117