灵长类特异性长链非编码RNA与癌症的关系
互联网
发表在《基因组生物学》(Genome Biology)杂志上的一项新研究发现,N-BLR是一种灵长类特异性非编码转录本,它可以调节上皮细胞向间质细胞的转化,并导致结肠直肠癌的侵袭和迁移。在这里告诉我们的是研究的作者乔治·卡林和伊西多·里古索斯。

序列保存在分子生物学中的相关性是无可争议的。自从莱纳斯·鲍林(Linus Pauling)和埃米尔·扎克坎德尔(Emile Zuckerkandl)在60年代早期的开创性工作以来,它一直是许多发现背后的驱动力。到60年代中期,Margaret Dayhoff已经在利用计算机绘制序列相似性和进化关系之间的联系,同时她的蛋白质图谱引入了基因家族的概念。
从那时起的50多年里,许多生物和病毒中保存程度不同的氨基酸和核酸序列被发现与基本途径有关。过去20年的发现,揭示了在数亿年的进化过程中被分隔的生物体中惊人的保护实例。
典型的例子包括let-7家族的调节非编码分子,被称为microRNAs (miRNAs),从蠕虫到人类都被保存下来,以及被称为TP53的肿瘤抑制基因,已知该基因在大象体内有40个副本,而大象是一种能够抵抗癌症发展的物种。也许并不奇怪,当这些保守序列被删除或改变时,疾病就开始了。
在很长一段时间里,这种偏离科学范式的情况很少发生。事实上,在文献中出现的反例是如此罕见,以至于生物学家、遗传学家和临床医生用这个观察结果作为支持保护规则的论据。也许最著名的早期非保守分子的例子是XIST。这就是序列守恒在研究人员的思想中所占的地位,即守恒很快就被认为不仅是充分的,而且是必要的。
随着鸟枪法测序在90年代后期成为规范,更多的基因组序列变得可用,从而促进比较。也许最著名的大规模跨基因组序列研究是由Haussler和Mattick小组进行的,他们发现了超冷服务元素(UCE)。UCEs是数百个核苷酸的延伸,从斑马鱼到人类高度保守。
第一次大规模的基因组序列研究是在2006年,由Rigoutsos小组进行的,他们调查了短序列基序在人类基因组中的分布情况。他们的研究导致了短序列的识别,这些短序列存在于信使rna中,并且在所谓的垃圾DNA中有更多的拷贝。他们称这些图案为“pyknons”,源自希腊语“密集”的意思。随后对人类和小鼠基因组的pyknons进行的比较研究表明,pyknons在缺乏序列保护或synteny的情况下获得了功能保护。
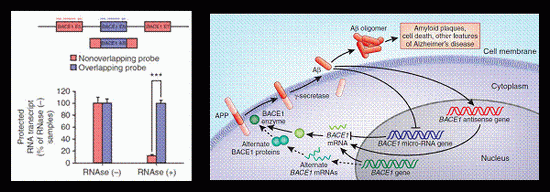
大约在同一时间,Calin组使用表达阵列来研究miRNAs、UCEs和少数pyknons在结肠癌中的作用。他们发现,针对几个UCEs和pyknons的探针显示正常组织和结肠癌之间的差异表达。2007年4月13日,我们俩在俄亥俄州立大学校园里的一次偶遇和一次简短的交谈,开启了我们实验室之间长达十年的合作,研究pyknons的生物学和潜在的临床意义。
我们在《基因组生物学》上发表的文章中展示了多个pyknon基序的例子,它们位于长时间的非编码转录本中,并在固态和液态癌症中表现出改变的表达。对于一个特定的转录本,N-BLR,我们还发现它充当进化保守的miR-200家族microRNAs的海绵,该家族已知可形成多种类型细胞的迁移和侵袭能力。
影响
我们的发现有几个含义。首先,值得注意的是,N-BLR序列存在于人类基因组和其他几种灵长类动物的基因组中,但不存在于啮齿类动物的基因组中。一个直接的结果是,N-BLR的生物学作用不能被结肠癌小鼠模型捕捉到
N-BLR中的pyknon基序在人类基因组中有许多拷贝,其中至少有一些可能被转录。这立即“链接”N-BLR到相应的位点,并将其与来自这些位点的任何转录本(“海绵”伙伴)结合。pyknon还将N-BLR链接到包含motif反向补充的位点(‘target’partners)。
所有这些联系意味着,在小鼠细胞中引入N-BLR(通过转染或工程)不太可能有助于研究其在人类环境中的作用:N-BLR的广泛的海绵和目标伙伴网络将缺席。
值得注意的是,以前曾有关于mirna、蛋白编码基因及其伪基因的类似偶联的报道。pyknon框架将长链非编码rna和信使rna以大量的组合方式连接在一起。
第二,以上的观察结果并不只适用于N-BLR。许多人类的pyknons要么是人类特有的,要么是灵长类特有的。回想一下,根据定义,每个这样的基序存在于至少一个信使RNA和多个基因组位点中。这表明一个潜在的广泛的非编码转录本网络,通过一个单独的,精确保守的pyknon基序与蛋白编码基因相互连接。
考虑到大量不同的人类pyknons(209,432),它们的实例可以转录成依赖于组织的组合,因此,复杂的和特定于生物体的耦合转录网络可能在起作用。这些网络将不会出现在小鼠模型中。众所周知,除了灵长类动物外,人类的癌症在其他动物模型中是不可能完全复制的,而pyknon层至少可以部分解释这一现象。
第三,我们的表达阵列实验探索了多个pyknons的基因组实例,结果表明,pyknon-containing转录本的丰度与miRNAs的丰度相当。此外,含pyknon的转录本的丰度模式似乎是组织特异性的,并在健康和疾病之间变化。由于我们设计了针对癌症相关基因组区域(CAGRs)的阵列探针,因此,这些区域的任何基因组中断都将反映在相应转录本的中断上。
第四,含pyknon的转录本的组织特异性行为增加了它们可能被用于识别新的生物标志物的可能性。这些替代的生物标志物可能使早期诊断和增加治疗选择的数量成为可能。然而,我们强调,这些观察结果是根据目前对这些分子进行的有限数量的实验推断出来的。需要大量的研究来评估这些转录本是否能帮助我们设计更可靠和可复制的标记。
最后,我们希望提到一种更有趣的可能性。可以想象,含pyknon的转录本在细胞之间循环,并代表一种只发生在人类身上的新类型的信号。反过来,这意味着只有人类细胞(包括免疫细胞)才有识别这些(暂时假定的)信号所需的传感器。如果这种可能性获得实验支持,相应的转录本将成为治疗性开发的主要候选。
考虑到N-BLR所代表的明显的复杂性,可以有把握地说,许多实验室将花费大量的工作来解决这些新的难题。我们相信,我们正处于通往未知的pyknonland的漫长旅程的开端。通过分享我们的见解,我们试图向《华尔街日报》的读者传达我们的兴奋之情,希望有相当多的人会决定从事研究工作,目的是破译这些含有pykine的转录本的作用。