合作专家 | 李煜钰博士
病理学与病理生理 首都医科大学
审核专家 | 于涛博士
生物化学分子生物 中国科学院大学
简介
染色质可及性通常也理解为染色质的开放程度。DNA 的复制以及转录,都需要将染色质的紧密结构打开,从而允许一些调控蛋白(比如转录因子和辅因子)与 DNA 结合。这部分被打开的染色质被称为开放染色质,其允许调控蛋白结合的特性称为染色质的可及性。
ATAC-seq(Assay for Transposase Accessible Chromatin with high-throughput sequencing),即利用转座酶 Tn5 研究染色质可及性的高通量测序技术,是目前针对染色质可及性测序的首选方法。
原理
ATAC-Seq 技术的原理是利用转座酶 Tn5 能够识别结合开放染色质区的 DNA,对其进行切割并在其两端加上特定序列的特性。如下图所示,只要将携带已知 DNA 序列标签的转座复合物(即带红色和蓝色序列标签的 Tn5 转座酶)加入到细胞核中一起孵育,再利用已知序列标签进行 PCR 扩增即可形成文库,经过测序并与基因组比对就可以获得染色质开放区的信息。
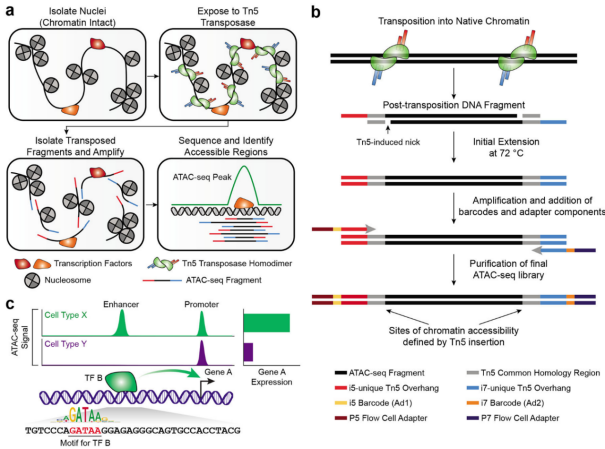
ATAC 转录和文库构建过程 Nat Protoc. 2022 Jun;17(6):1518-1552.
用途
(1)绘制染色质开放性图谱;
(2)寻找调控生物学过程的关键转录因子;
(3)寻找转录因子调控的靶基因;
(4)增强子的鉴定及发现;
(5)寻找核小体的定位;
(6)探索与疾病有关的调控机制。
材料与仪器
步骤
样品准备:
(1)细胞样品:
a) PBS 清洗细胞两遍,贴壁细胞用 0.5% 胰酶消化成悬浮细胞;
b) 用含 10% FBS 的 DMEM 中止消化;
c) 将中止消化的细胞 4 °C、500 g 离心 5 分钟,小心吸掉全部上清;
d) 用冻存液(60% 完全培养基+ 30% FBS + 10% DMSO)(体积比)重悬细胞沉淀,按照上面规定的细胞量进行分装,移至冻存管;
e) 将冻存管置于程序降温冻存盒,放到 -80 度冰箱进行梯度降温并暂时保存;
f) 干冰送至测序公司;
(2)动物/植物组织样品:
a) 取下新鲜组织样本,去除多余组织等杂质;
b) 将组织样本转移至新的离心管中,用预冷的 PBS 溶液冲洗干净;
c) 用无尘纸擦干水分,如果组织体积较大,应在冰上将组织切成小块或薄片(每份约 50 mg);之后置于 2 ml 旋盖冻存管内,准备标记样本名称;
d) 迅速置于液氮中冷冻 30 mins,然后转移至 -80 度冰箱中保存;
e) 干冰中冻存送至测序公司;
1, 组织(细胞)细胞核提取
(1)根据细胞核分离试剂盒说明书完成
(2)LB 溶液中加入 BSA,终浓度为 1%,现配现用
(3)取 2 ml EP 管,加入 1 ml LB
(4)向样本中加入裂解液,匀浆仪打碎研磨
(5)冰上充分裂解 5~10 分钟
(6)40 μm 细胞筛去除杂质,4 ℃,500 g 离心 5 分钟
(7)弃上清,加入 300 μl LB 溶液,重悬,转移至新的 EP 管中
(8)加入 300 μl PB1 溶液,吹打混匀
(9)缓慢在溶液底层加入 600 μl PB2 溶液,使得溶液分层
(10)缓慢在溶液底层加入 600 μl PB3 溶液,使得溶液分层
(11)4 ℃,3000 g 离心 20 分钟
(12)细胞核位于 PB2 和 PB3 溶液交界处,依次移除最上层 600 μl 上清,细胞核层以上 500 μl 体积的液体
(13)加入 NB 溶液吹打混匀,过细胞筛,4 ℃ 500 g 离心 5 分钟
(14)缓慢吸除上清,加入 0.5 mL NB 溶液,重悬
(15)4 ℃ 500 g 离心 5 分钟,去上清,加入 50 μl NB 溶液,吹打重悬细胞核
(16)分别取 5 μl 细胞核悬液,台盼蓝染色,用于细胞核计数核显微镜观察
2, Tn5 酶转座反应
(1)在 PCR 管中配置如下打断 Mix:

(2)用打断 Mix 重悬细胞核,并用移液器轻轻吹打混匀;
(3)PCR 仪 37℃ 反应 30 min(可根据安捷伦 2100 结果适当延长时间);
3, DNA 纯化、建库、上机测序
(1)利用 VAHTS DNA Clean Beads(使用前先恢复至室温)纯化 DNA:
(2)磁珠和上述 PCR 产物混匀,室温孵育 5 min;
(3)将 PCR 管置于磁力架上,用 200μl 新鲜配置的 80% 乙醇漂洗两次,随后小心移除上清;
(4)开盖干燥 5 min;
(5)磁珠晾干后,用 22 μl 双蒸水洗脱磁珠上的 DNA;
(6)随后用 P5/P7 引物 PCR 扩增建库;
(7)得到的文库再用 VAHTS DNA Clean Beads 纯化;
(8)用 Q-bit 测定文库浓度,安捷伦 2100 检测文库片段分布;
(9)文库交由测序公司测序。
4, 生物信息学分析(根据个人需求进行分析)
注意事项
1. 在样本制备过程中,应将提前配置细胞冻存液置于冰上预冷,防止新配置的冻存液过热损伤细胞,待冻存液恢复室温后使用。
2. 样本送样时最好额外制备 1~2 份进行备份,以防后续实验出现差错无法补救。
3. 在细胞核提取相关实验中,所有试剂均需要添加蛋白酶抑制剂、RNase 抑制剂及 DTT。
4. 在细胞核提取相关实验中,LB 溶液中加入 BSA,终浓度为 1%,应现配现用。
来源:丁香实验