简介
我的 WB 经验分享,快来帮我点赞吧!
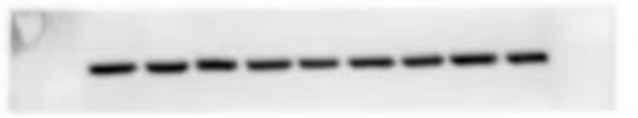
原理
SDS-PAGE
1、 首先将厚玻璃板和薄玻璃板用洗洁精清洗干净,在烘箱里将玻璃板烘干,或者用吹风机吹干,将玻璃板对齐后放入到架子中,注意把两侧的夹子卡紧(薄玻璃靠外,厚玻璃靠内),防止漏胶。
2、 然后垂直卡在架子上准备灌胶。操作时要使两玻璃对齐,以免漏胶。图示两块玻璃板放在一个架子上。
3、 配制分离胶(一般每块 8 ml):根据表 1 配制分离胶,将对应组分加好后立即摇匀即可灌胶。灌胶时,可用 5 mL 枪吸取 5 mL 分离胶沿玻璃板放出,或者直接倒胶,待胶面升到绿带中间线高度时即可。然后胶上加一层水,加速分离胶的凝集速度。
(灌胶时开始可快一些,胶面快到所需高度时放慢速度。操作时胶一定要沿玻璃板流下,这样才不会产生气泡。加水液封时也要很慢,否则胶会被冲变型。)
4、 配制浓缩胶(2 ml):将梳子洗干净后吹干备用,待水和胶之间有一条折线时(大约 30 min),说明分离胶已经凝固,倒去上层水并用滤纸将水充分吸干。根据表 2 配制积层胶,将对应组分加好后立即摇匀即可灌胶,灌满后小心均匀的将梳子插入即可。
5、 蛋白变性:按照样本 : 5× SDS = 4 : 1 的比例稀释样本,99℃ ,7 min 蛋白变性即可,上样时根据蛋白浓度调整上样量即可。
6、 固定玻璃板:待浓缩胶干后,将玻璃板从夹子上取下来,稍微用水冲一下, 然后用固定夹将玻璃板固定好(若跑一块胶,则槽的另一边需垫一块塑料板)。玻璃板固定好以后将固定夹夹紧并放在电泳槽内,之后往电泳槽内加入一定量的 1× 电泳液(电泳液至少要漫过内侧的小玻璃板),确定没有漏液现象后用手拿住梳子的两边均匀用力,拔起梳子,准备上样。
7、 上样:在保证每孔上样量一致的前题条件下,根据蛋白浓度的测定结果计算出每孔的上样量。用微量进样器贴壁吸取样本,将样本吸出时注意不要吸进气泡。将加样器针头插至加样孔中缓慢加入样品。(加样太快可能会导致样品冲出加样孔,若有气泡也可能使样品溢出。一般最左边的泳道加入 4-5μL Marker。)
8、 凝胶电泳:上样完毕后即可开始跑电泳(跑电泳前需先确定电泳槽的正负极是否插对),电泳时间一般为 1-2h,当蛋白样本在浓缩胶中时,可适当控制电压,以便更好的浓缩蛋白样本,一般控制在 60-80V,待蛋白样本跑进分离胶后,可适当加大电压,一般控制在 100-120V,电泳至溴酚蓝跑出即可终止电泳。
(四) 转膜(湿转)
PVDF 膜:蛋白分子量<20kDa,用0.22μm,>20kDa,用 0.45μm 转膜时记得标记膜的正负。
1、 电泳结束后取出转移槽,并把玻璃板取下,将玻璃板撬开后即可剥胶,撬的时候动作要轻,要在两个边上轻轻的反复撬。撬时一定要小心,玻璃板很容易裂开。玻璃板撬开后将浓缩胶和分离胶上不用的部分切去。
2、 在加有转膜液的玻璃皿里放入甲醇,用于激活 PVDF 膜(1-2 min),将夹子打开使白的一面保持水平。在上面垫一张海绵垫,用玻璃棒来回滚几遍以去除里面的气泡。在垫子上垫 1-2 层滤纸(薄滤纸两层,厚滤纸一层),一手固定滤纸,一手用玻璃棒除去其中的气泡。
3、 按照从负极(黑色)到正极(白色)的顺序依次将滤纸-胶- PVDF 膜-滤纸叠加在一起。最后盖上另一个海绵垫,合起夹子。膜两边的滤纸不能相互接触,接触后会发生短路。转膜液中含甲醇,操作时应戴手套,并注意通风。夹子合起后可放入到转移槽中去,注意使夹子的黑色一面对操的黑面,白色的一面对槽的红面(正负极不要搞混淆)。然后往转移槽中倒入一定量的转膜液(需预冷),并在另一侧放入冰盒(用于降温)。
4、 最后把盖子合上后放入到装有冰的泡沫盒子里去,打开电源,设定恒定电流, 开始转膜(一般恒流 252mA,转膜 1-2h 即可,根据蛋白分子量确定转膜时间)。
(五) 抗体的孵育
1、 一抗的孵育:转膜结束后,即可打开盖子并取出夹子,将膜取出,将膜用 TBST 洗涤 2-3 次后,转移至含有封闭液的平皿中(5% 的脱脂牛奶(用 TBST 配)或者 5% 的BSA),室温摇床封闭 1h 后即可孵育一抗(按所需稀释浓度滴加一抗,4℃ 过夜或者 37℃ 孵育 3h);
2、 孵育二抗:第二天取出膜,用 TBST 洗三次,每次 10min,然后加入已经配制好的二抗。室温孵育 1h,再用 TBST 洗三遍,每次 10min 即可准备显影。
(六) 显影和成像分析:一般采用化学发光法显影,并利用 BioRAD 的 ChemiDoc XRS 系统进行成像分析。
ECL 显影液 : 两个工作液=1 : 1, 10 孔一共需 200 μl。
用途
测蛋白表达
材料与仪器
玻璃板,电泳仪,转膜夹,转膜电极,抗体,孵育盒,电泳液,转膜液,甲醇,PVDF膜等。
步骤
SDS-PAGE
1、 首先将厚玻璃板和薄玻璃板用洗洁精清洗干净,在烘箱里将玻璃板烘干,或者用吹风机吹干,将玻璃板对齐后放入到架子中,注意把两侧的夹子卡紧(薄玻璃靠外,厚玻璃靠内),防止漏胶。
2、 然后垂直卡在架子上准备灌胶。操作时要使两玻璃对齐,以免漏胶。图示两块玻璃板放在一个架子上。
3、 配制分离胶(一般每块 8 ml):根据表 1 配制分离胶,将对应组分加好后立即摇匀即可灌胶。灌胶时,可用 5 mL 枪吸取 5 mL 分离胶沿玻璃板放出,或者直接倒胶,待胶面升到绿带中间线高度时即可。然后胶上加一层水,加速分离胶的凝集速度。
(灌胶时开始可快一些,胶面快到所需高度时放慢速度。操作时胶一定要沿玻璃板流下,这样才不会产生气泡。加水液封时也要很慢,否则胶会被冲变型。)
4、 配制浓缩胶(2 ml):将梳子洗干净后吹干备用,待水和胶之间有一条折线时(大约 30 min),说明分离胶已经凝固,倒去上层水并用滤纸将水充分吸干。根据表 2 配制积层胶,将对应组分加好后立即摇匀即可灌胶,灌满后小心均匀的将梳子插入即可。
5、 蛋白变性:按照样本 : 5× SDS = 4 : 1 的比例稀释样本,99℃ ,7 min 蛋白变性即可,上样时根据蛋白浓度调整上样量即可。
6、 固定玻璃板:待浓缩胶干后,将玻璃板从夹子上取下来,稍微用水冲一下, 然后用固定夹将玻璃板固定好(若跑一块胶,则槽的另一边需垫一块塑料板)。玻璃板固定好以后将固定夹夹紧并放在电泳槽内,之后往电泳槽内加入一定量的 1× 电泳液(电泳液至少要漫过内侧的小玻璃板),确定没有漏液现象后用手拿住梳子的两边均匀用力,拔起梳子,准备上样。
7、 上样:在保证每孔上样量一致的前题条件下,根据蛋白浓度的测定结果计算出每孔的上样量。用微量进样器贴壁吸取样本,将样本吸出时注意不要吸进气泡。将加样器针头插至加样孔中缓慢加入样品。(加样太快可能会导致样品冲出加样孔,若有气泡也可能使样品溢出。一般最左边的泳道加入 4-5μL Marker。)
8、 凝胶电泳:上样完毕后即可开始跑电泳(跑电泳前需先确定电泳槽的正负极是否插对),电泳时间一般为 1-2h,当蛋白样本在浓缩胶中时,可适当控制电压,以便更好的浓缩蛋白样本,一般控制在 60-80V,待蛋白样本跑进分离胶后,可适当加大电压,一般控制在 100-120V,电泳至溴酚蓝跑出即可终止电泳。
(四) 转膜(湿转)
PVDF 膜:蛋白分子量<20kDa,用0.22μm,>20kDa,用 0.45μm 转膜时记得标记膜的正负。
1、 电泳结束后取出转移槽,并把玻璃板取下,将玻璃板撬开后即可剥胶,撬的时候动作要轻,要在两个边上轻轻的反复撬。撬时一定要小心,玻璃板很容易裂开。玻璃板撬开后将浓缩胶和分离胶上不用的部分切去。
2、 在加有转膜液的玻璃皿里放入甲醇,用于激活 PVDF 膜(1-2 min),将夹子打开使白的一面保持水平。在上面垫一张海绵垫,用玻璃棒来回滚几遍以去除里面的气泡。在垫子上垫 1-2 层滤纸(薄滤纸两层,厚滤纸一层),一手固定滤纸,一手用玻璃棒除去其中的气泡。
3、 按照从负极(黑色)到正极(白色)的顺序依次将滤纸-胶- PVDF 膜-滤纸叠加在一起。最后盖上另一个海绵垫,合起夹子。膜两边的滤纸不能相互接触,接触后会发生短路。转膜液中含甲醇,操作时应戴手套,并注意通风。夹子合起后可放入到转移槽中去,注意使夹子的黑色一面对操的黑面,白色的一面对槽的红面(正负极不要搞混淆)。然后往转移槽中倒入一定量的转膜液(需预冷),并在另一侧放入冰盒(用于降温)。
4、 最后把盖子合上后放入到装有冰的泡沫盒子里去,打开电源,设定恒定电流, 开始转膜(一般恒流 252mA,转膜 1-2h 即可,根据蛋白分子量确定转膜时间)。
(五) 抗体的孵育
1、 一抗的孵育:转膜结束后,即可打开盖子并取出夹子,将膜取出,将膜用 TBST 洗涤 2-3 次后,转移至含有封闭液的平皿中(5% 的脱脂牛奶(用 TBST 配)或者 5% 的BSA),室温摇床封闭 1h 后即可孵育一抗(按所需稀释浓度滴加一抗,4℃ 过夜或者 37℃ 孵育 3h);
2、 孵育二抗:第二天取出膜,用 TBST 洗三次,每次 10min,然后加入已经配制好的二抗。室温孵育 1h,再用 TBST 洗三遍,每次 10min 即可准备显影。
(六) 显影和成像分析:一般采用化学发光法显影,并利用 BioRAD 的 ChemiDoc XRS 系统进行成像分析。
ECL 显影液 : 两个工作液=1 : 1, 10 孔一共需 200 μl。
注意事项
上样不能太快,跑胶电压梯度设置,转膜不能有气泡,敷抗体时间合理。
常见问题
同样的上样体积,跑内参,跑出来灰度值不同,显影液如何均匀滴加,转膜完成后 marker 会晕开,怎样避免转膜产热较高。
来源:丁香实验