简介
学习和掌握氯化硝基四氮哩蓝(NBT)光化还原法测定SOD活力的方法和原理。并了解SOD的作用特性。
原理
1. 植物在逆境胁迫或衰老过程中,细胞内自由基代谢平衡被破坏而有利于自由基的产生。自由基是具有未配对价电子的原子或原子团。生物体内产生的自由基主要有超氧自由基(O2-・)、羟自由基(OH・)、过氧自由基(ROD)、烷氧自由基(RO)等。
植物细胞膜有 酶促和非酶促两类过氧化物防御系统,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物 酶(POD)和抗坏血酸过氧化物酶(ASA-POD)等是酶促防御系统的重要保护酶。抗坏血酸 (维生素C)、维生素E和还原型谷胱甘肽(GSH)等是非酶促防御系统中的重要抗氧化剂。 CAT等活性氧清除剂的含量水平以及O2-・、H2O2、OH · 和O2等活性氧的含量水平可作为植物衰老的生理生化指标。
超氧化物歧化酶(superoxide dismutase,SOD)是含金属辅基的酶。高等植物含有两种类 型的SoD:Mn-SOD和Cu. Zn-SOD,它们能通过歧化反应清除生物细胞中的超氧自由基 (O2-・),生成 H2O2 和 O2。H2O2由过氧化氢酶(CAT)催化生成H2O和O2。从而减少自由基对有机体的毒害。反应式如下:
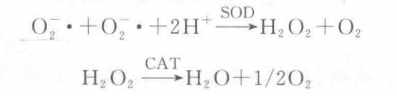
由于超氧自由基(O广)为不稳定自由基,寿命极短,测定SOD活性一般为间接方法,并利用各种呈色反应来测定SOD的活力。核黄素在有氧条件下能产生超氧自由基负离子O2-・,当加入NBT后,在光照条件下,与超氧自由基反应生成单甲膳(黄色),继而还原生成二甲腊,它是一种蓝色物质,在560 nm波长下有最大吸收峰。
当加入SOD时,可以使超氧自由基与H+结合生成H2O2和O2,从而抑制了NBT光还原的进行,使蓝色二甲腊生成速度减慢。通过在反应液中加入不同量的SOD酶液,光照一定时间后测定560 nm波长下各液光密度值,抑制NBT光还原相对百分率与酶活性在一定范围内呈正比,以酶液加入量为横坐标, 以抑制NBT光还原相对百分率为纵坐标,在坐标纸上绘制出二者的相关曲线,根据SOD抑 制NBT光还原相对百分率计算酶活性。找出SOD抑制NBT光还原相对百分率为50% 时的酶量作为一个酶活力单位(U)。
材料与仪器
步骤
超氧化物歧化酶(SOD)活力测定的基本过程可分为如下几步:
1. 酶液的制备:按每克鲜叶加入3 mL 0.05 mol · L-1pH 7. 8磷酸钠缓冲液,加入少量石 英砂,于冰浴中的研钵内研磨成匀浆,定容到5 mL刻度离心管中,于8 500 r · min-1: (10 000 g)冷冻离心30 min,上清液即为SOD酶粗提液。
2. 酶活力的测定:每个处理取8个洗净干燥好的微烧杯编号,按表38-1加入各试剂及酶液,反应系统总体积为3 mL。其中4~8号杯中磷酸钠缓冲液量和酶液量可根据试验材料中酶液浓度及酶活力进行调整(如酶液浓度大、活性强时,酶用量适当减少)。
各试剂全部加入后,充分混匀,取1号微烧杯置于暗处,作为空白对照,比色时调零用。 其余7个微烧杯均放在温度为25 °C ,光强为4 500 lx的光照箱内(安装有3根20 W的日光灯 管)照光15 min,然后立即遮光终止反应。在560 nm波长下以1号杯液调零,测定各杯液光 密度并记录结果。以2、3号杯液光密度的平均值作为抑制NBT光还原率100%,根据其他各 杯液的光密度分别计算出不同酶液量的各反应系统中抑制NBT光还原的相对百分率。以酶 液用量为横坐标,以抑制NBT光还原相对百分率为纵坐标,作出二者相关曲线。找出50% 抑制率的酶液量(ptL)作为一个酶活力单位(U)。
1. 结果计算:
(1)测560 nm波长下各杯液的光密度填于表38-2中。

以酶液加入量为横坐标,以抑制NBT光还原相对百分率为纵坐标,在坐标纸上绘制出二 者相关曲线。找出50% 抑制率的酶液量(卩L)作为一个酶活力单位(U)。
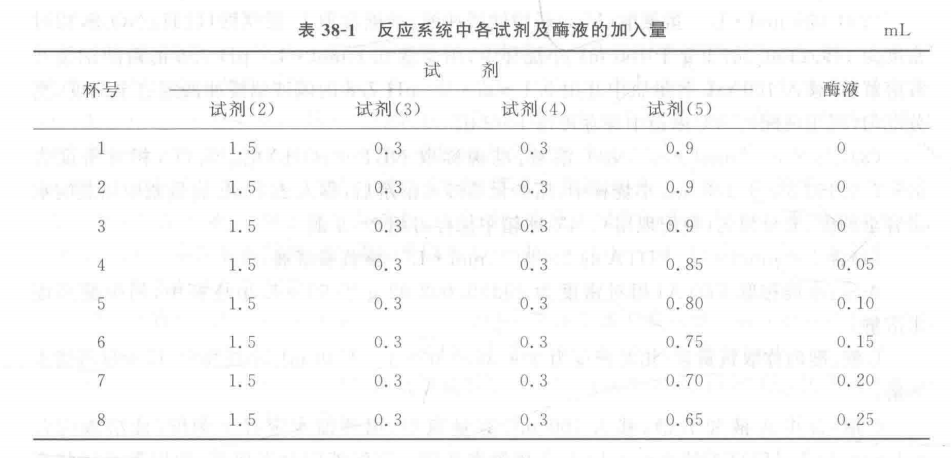
(2)SOD酶活力按下式计算:
V一酶提取液总体积,mL;
B——个酶活力单位的酶液量,μL;
W一样品鲜重,g;
T一反应时间,min;
1 000—1 mL=1000 μL
60一1 h=60 min。
抑制率按下式计算:
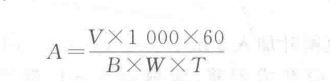
式中:9—2、3号杯液的光密度平均值;
D?一加入不同酶液量的各杯液的光密度值。
注:有时因测定样品的数量多,每个样品均按此法测定酶活力工作量将会很大,也可每个 样品只测定1个或2个酶液用量的光密度值,按下式计算酶活力。
式中:D1一2、3号杯液的光密度平均值;
D2 -测定样品酶液的光密度;
50% —抑制率为50% ;
其他各因子代表的内容与上述SOD酶活力计算公式的各因子代表的内容相同。
注意事项
1. 富含酚类物质的植物(如茶叶)在匀浆时产生大量的多酚类物质,会引起酶蛋白不可逆沉淀,使酶失去活性,因此在提取此类植物SOD酶时,必须添加多酚类物质的吸附剂,将多酚 类物质除去,避免酶蛋白变性失活,一般在提取液中加1% ~4% 的聚乙烯毗咯烷酮(PVP)。
2. 测定时的温度和光化反应时间必须严格控制一致。为保证各微烧杯所受光强一致,所有微烧杯应排列在与日光灯管平行的直线上。
来源:丁香实验



![PBST [10X]; Phosphate buffered saline with Tween-20; 80mM Na2HPO4, 1.5M NaCl, 20mM KH2PO4, 30mM KCl, 0.5% Tween-20, pH 7.4](https://img1.dxycdn.com/p/s14/2025/0321/123/2914240281077792091.jpg!wh200)



