融合PCR实验
最新修订时间:
简介
融合 PCR 是通过 PCR 的方法,将两段 DNA 序列连接到一起,处于相邻位置。一般来说, 融合 PCR 设计的引物序列的 5’端和 3' 端各包含一段待融合的模板序列,这条引物相当于衔接头,将两段 DNA 序列连接到一起。融合 PCR 技术最常用于全长序列的拼接,现在随着技术的发展,逐步应用于基因的破坏、基因的标记、序列缺失、两种基因的融合等领域。
原理
融合 PCR 实验的基本原理是通过在上游引物的 5’端添加一段帽子序列,这 段帽子序列与靶 1 序列同源;而此引物的 3’端序列与靶 2 序列同源。这样,在第一个 PCR 反应中,以靶 2 序列为模板,使靶 2 序列得到扩增,而 扩增产物均携带与靶 1 序列同源或互补的序列。然后,以这样的扩增产物为引物,在第二个 PCR 反应中,以靶 1 序列为模板,使靶 1 序列得到扩增。这样得到的产物既含有靶 1 序列,又含有靶 2 序列,成为一段长片段的融合序列(见图 10-5)

材料与仪器
器材:
PCR 仪、电泳仪等。
步骤
融合 PCR 实验的基本过程可分为如下几步,应用于基因插入的融合 PCR 的具体操作步骤,融合 PCR 过程如图 10-6 所示:

A 用标准的 PCR 方法,进行 3 个独立的 PCR 反应
PCR 反应 1:获得一个标签序列:采用引物 tag-F 和 Wg-R。
PCR 反应 2:获得目的基因起始密码子 ATG 的上游序列,约 500bp,采用的引物为 up-F 和 up-R,其中 up-R 含 24 bp 的序列与标签序列的 5’互补。
PCR 反应 3:获得目的基因起始密码子 ATG 及其下游序列,约 500 bp,釆用的引物为 do-F 和 do-R,其中 do_F 含 24 bp 序列与标签序列的 3’互补。
B 融合 PCR 反应
反应体系:3 种 PCR 产物按照大致相同的摩尔比混合(PCR 产物最好先分别纯化),总量约 100 ng,然后配成 50 μL 的反应体系,包括 5 μL 含 MgSO4 的 Pwo 聚合酶缓冲液、各 0. 2 mmol/L 的 dNTP,补加去离子水至 49 μL,将此反应体系加热到 94 °C 后,补加 1 μL Pwo 聚合酶(Roche)。
反应条件:94 ℃ 30 s-55 ℃ 1 min-72 ℃ 3.5 min,共进行 5 个循环。目的是使 3 种 PCR 产物互补延伸,最终形成全长的融合 PCR 产物。
C 融合 PCR 产物的进一步扩增
上面的 5 个循环做完以后,反应体系加热到 94 ℃,另加入 50 μL 反应溶液(5μL 含 MgSO4 的 Fwo 聚合酶缓冲液,各 0.2 mmol/L 的 dNTP, 1 μL Pwo 聚合酶,以及 5’和 3’端最末端的引物 up- F 和 dbR,去离子水补足额定体积)o 以 94 ℃ 30 s-55 ℃ 1 min-72 ℃ 3.5 min 为 PCR 反应条件,共进行 25 个循环。
得到的融合 PCR 产物包含起始密码子 ATG 上游 500 bp 的序列,标签序列,以及起始密码子 ATG 及其下游 500 bp 的序列。
注意事项
1 同源互补区域的长度
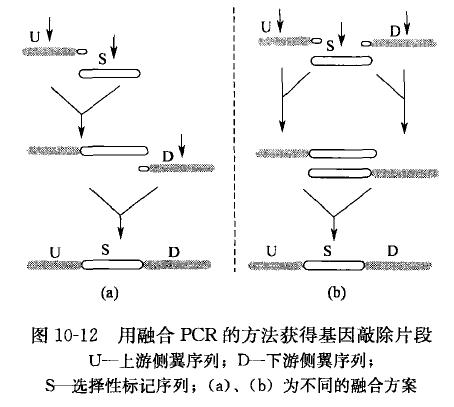
由于融合 PCR 主要是利用两个片段 3’端的互补序列进行融合,所以待融合的片段越长,完整的融合产物的量越少。有时扩增产物在凝胶电泳中难以检测。但将待融合的两个片段之间的同 源互补区延长是增加融合物产量的一个好办法。如图 10-12 中操作流程(b)所示容易获得高产量,而操作流程(a)得到的产物量少卬七范宝昌等为了获得登革 2 型病毒的全长 cDNA 分子,将 5’半分子和 3’半分子的互补序列长度增加到 1.6 kb,保证了半分子退火后的正确匹配和中间体的稳定。
2 DNA 聚合酶的性能
融合 PCR 结果有时不理想,也与采用的 DNA 聚合酶的性能有关。在绝大多数情况下,推荐使用高保真的 DNA 聚合酶,以最大限度减少突变的产生。但保真性能好,扩增能力就有一定的局限,比如范宝昌等为了保证 11 kb 融合产物的获得,采用的是具有较好扩增能力,但保真度略低于 Pfu 的高保真 PCR 系统(B.M. 公司)。Wang 等的实验结果证明,如果高保真的 DNA 聚合酶的融合扩增效果不好,可以尝试利用普通 Taq 酶和高保真的 DNA 聚合酶混合使用。因为有的高保真 DNA 聚合酶对从琼脂糖凝胶和电泳缓冲液来源的模板比较敏感,不易获得好的扩增效果。
3 PCR 引物的设计和 PCR 反应条件
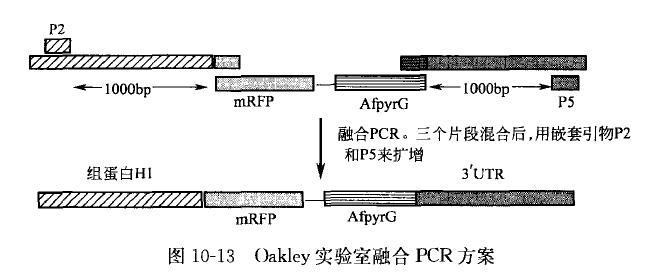
Oakley 实验室在进行如图 10-13 的融合 PCR 时,发现引物 P2 和 P5 距各自融合端衔接头的最佳距离为 1000 bp 左右,至于 P2、P5 以及待融合片段的重叠区域的长度都仅有 18〜21 bp。另外,他们为了保证在不同的 PCR 仪器上做出相同的 PCR 结果,他们规定了如下精细的 PCR 条件:
① 94 ℃, 2 min;
② 10 个循环:94 ℃ 20s,70℃ 1s,以 0.1 ℃/s 的速度降到 55 ℃,55 ℃ 30 s,以 0.2 ℃/s 升温 到 68 ℃,68°C 5 min;
③ 5 个循环:94 ℃ 20s, 70 ℃ Is,以 0.1℃/s 的速度降到 55 ℃, 55 ℃ 30 s,以 0.2 ℃/s 升温到 68 ℃,68 ℃ 5 min(以后每个循环加 5 s,最后一个循环延伸时间为 5 min 20 s);
④ 10 个循环:94 ℃ 20 s, 70 ℃ 1 s,以 0.1 ℃/s 的速度降到 55 ℃ , 55 ℃ 30 s,以 0.2 ℃/s 升温 到 68 ℃, 68 ℃ 5 min 20 s(以后每个循环加 20 s,最后一个循环延伸时间为 9 min 20 s);
在步骤 ③ 和 ④ 中,延伸时间的延长是考虑到 Taq 酶的活力在逐步减弱。经过他们的严格而精细的 PCR 程序设定,得到了单一而高浓度的特异性产物。
4 引物比例
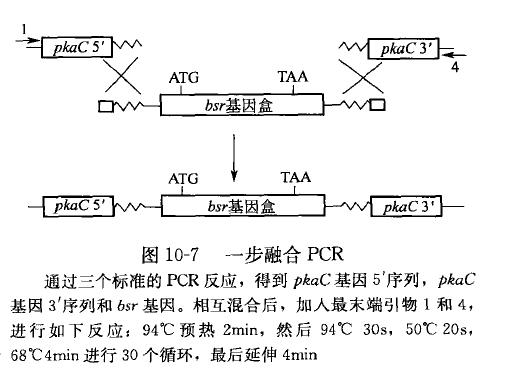
实验操作中也发现,不同引物的比例也影响融合 PCR 结果。在一步融合 PCR 反应中,(原理同图 10-7 所示),Karremann 在同一个反应管中添加了所有的三种引物和需要的模板,利用一个 PCR 反应来获得融合产物。他发现,引物 1 的量对融合 PCR 的结果关系密切。当引物引物 2:引物 3 的比例为时,中间产物的积累效果明显,而融合产物的量少;当引物量之比为时,融合产物的量占到绝大多数;当进一步增大引物 1 与引物 2 和 3 的比例时(1:100:100、1:1000:1000. 1:10000:10000),融合 PCR 效果变得很差,几乎检测不到融台产物。因此,引物 1:引物 2:引物 3 的比例应保持在合适的水平。
来源:丁香实验