Raf 蛋白 Ras 结合结构域的简并进化库合成以及利用片段互补法快速筛选二氢叶酸还原酶的克隆
相关实验:Raf蛋白Ras结合结构域的简并进化库合成以及利用片段互补法快速筛选二氢叶酸还原酶的克隆实验
最新修订时间:
材料与仪器
步骤
3.1 概论
3.1.1 PCA 对空间排列的要求
PCA 片段的三维朝向对于 PCA 报告蛋白是否能正确折叠至关重要,它取决于形成复合体的目的蛋白 N 端或 C 端的朝向(图 15.1 示意了在连接设计中对空间位置的考虑)。因此,在设计蛋白一PCA 片段融合体时,以何种方式将蛋白质片段连接在一起使其能够折叠形成天然结构是非常重要的。融合蛋白能否正确折叠受融合蛋白的末端朝向和片段间接头(linker) 长度两个因素的影响。我们将片段 GGGGS 应用于多种不同蛋白质,证明这个序列在大肠杆菌、酵母和哺乳动物细胞表达系统中效果都比较好。我们认为这个序列可以改善融合蛋白的弹性和可溶性,从而有利于其组装,而且由于此序列中不含天然蛋白酶识别位点,确保了融合蛋白的稳定性。虽然此类的接头受到青睐,但并不表示使用它就一定能得到可以互补的片段 [ 31,32,39] 。然而,还是要避免使用诸如脯氨酸和分支氨基酸类的大的疏水和刚性氨基酸。在大多数蛋白质工程的问题中,形成复合体的目的蛋白的三维结构是已知的,因此可以设计复合体的方向并计算出所需接头的长度。对于 DHFR PCA 来说,融合蛋白 N 端和 C 端的空间构象需求是已知的 [ 31,44 ] 。例如,如果将目的蛋白分别与F[ 1 ,2 ] 的 C 端和 F[ 3 ] 的 N 端融合,那么构建时所需的接头就可以很短甚至不需要,因为这种构建方法已经考虑到了 DHFR 的拓扑结构;但是如果将目的蛋白分别构建到两个片段的 N 端,要使 DNFR 能正确组装,就必须在两个融合蛋白之间插入至少两个氨基酸作为接头(每个肽键大约 3.75 A ) ,因为 DNFR 两个片段 N 端的距离将近 10A。在 ras 和 RBD 的例子中就选择了这种构建方式。然而,观察 raf RBD 与 ras 髙类似蛋白 raplA 的复合体结构发现这两个蛋白质的 C 端距离 40A,这就需要在每个融合蛋白中插入至少 6 个氨基酸的接头。对于文库筛选来说,我们将每个接头的总长度定为 14 个氨基酸,其中包括限制性内切核酸酶位点,以确保融合蛋白具有足够的灵活性。

3.1.2 对照和严密性
在利用 DHFR PCA 进行蛋白质工程研究和文库筛选之前,必须做严格的对照实验用以估计其对特定的测试系统的灵敏度和严密性。理想条件下,在进行文库筛选前,实验者应大概了解 PCA 对于一个给定的相互作用体的解离常数 Kd 的极限。不同的相互作用蛋白对有着不同的灵敏度极限(PCA 可以检测到的最大 Kd ),但是 Kd 值又受到融合蛋白表达水平、蛋白质表达总量中可溶蛋白比例以及诸如稳定性、可溶性和蛋白质折叠、结合参数等蛋白质自身性质的影响。如果 PCA 十分灵敏,可以检测到两个特定蛋白质间非常弱的相互作用,它就不能在众多的克隆中选出最好的相互作用蛋白对;也就是说,此项实验过于灵敏从而丧失了严密性。因此,平衡灵敏度和严密性的关系至关重要。为了解决这一问题,在 PCA 实验前通常需要做些对照实验,虽然不是所有的这些对照都与特定的蛋白质工程研究相关,我们在后面还会再讨论这个问题。
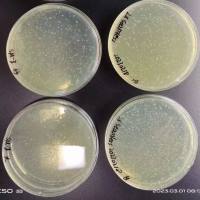
( 1 ) 伪组装(spurious reassembly): 要使 PCA 能有效工作,应避免片段间微弱的或非特异性的相互作用。对于一个给定的相互作用蛋白对测试系统来说,PCA 有效的灵敏度可以通过对照 4 和 6 来估算。如果灵敏度过高,如长出不该有相互作用的蛋白对的菌落(图 15.2A ) ,可以通过降低表达水平或通过对照 2 中所述的严密性突变来降低灵敏度(图 15.2B)。
( 2 ) 严密性突变(stringency mutant):突变 DHFR 两片段相互作用表面上的氨基酸残基侧链的效果,如已报道的 F[ 3 ] 的 I114A 突变。在克隆表达通过形成亮氨酸拉链 ( leucin zipper) 而相互作用的蛋白对时,菌落生长速度和数量无法区分不同蛋白对间的结合效率。后来,在 F[ 3 ] 中引入突变 I114A,改变了 PCA 的灵敏度,使其可以应用于亮氨酸拉链系统。这种灵敏度的变化可以通过一步筛选的选择因子(selection factor) 来衡量,选择因子等于共转化细胞数除以在选择压力下存活菌落数。数值越高严密性越高,所以在合理数量的重复竞争下,可以挑选出最好的相互作用亮氨酸拉链异源二聚体 [32]。

( 3 ) 片段置换(fragment sw apping):无论将相互作用的两个蛋白质分别与 PCA 系统的哪个片段融合,理论上应不影响两个目的蛋白的相互作用。因此,置换与两个目的蛋白质融合的片段应得到类似可比的结果。
( 4 ) 无相互作用蛋白质(noninteracting protein) : 如果已知一个蛋白质不和任何一个用于 PCA 测试的目的蛋白有相互作用,理应检测不到 PCA 反应(图 15.2A ) ,并且单独过量表达这个蛋白质也不会对已知的相互作用有竞争影响。
( 5 ) 通过竞争实验滴定和降低报告蛋白的酶活:报告蛋白的活性应随着两个融合蛋白表达比例的变化而改变;而且同时单独过量表达相互作用蛋白的其中之一应减弱 PCA 反应的活性。然而,应谨记每个融合蛋白相应的可溶性和稳定性、相互作用蛋白质间的亲和力对比它们的胞内浓度以及 PCA 的灵敏度都会对 titrate 报告蛋白的活性造成影响。因而可以通过降低融合蛋白的表达水平或整合对照 2 和对照 6 来调节报告蛋白的活性,从而降低互补效率。
( 6 ) 破坏相互作用:可以预测,在形成复合体的一个单体中插入特定的点突变或删除突变破坏或减弱目的蛋白相互作用力也会影响 PCA 反应。
如果蛋白质工程项目中用于研究的模型性质已经相当清楚,那么只有对照 1、对照 2、对照 4 和对照 6 对于确定实验的特异性和准确性是必需的。RBD-ras 的互补突变实验及突变对亲和常数 Kd 的影响已有相关报道,基于这些数据我们构建了若干突变,使 RBD-ras 相互作用的 Kd 值降低了三个数量级(图 15.3 例子)。我们将这些突变体和其他突变体都用于 DHFR-PCA 测试,以确保这项实验可以在 1 μmol/L 的数量级上检测到 RBD 与 ras 的相互作用。另外,已发表的降低蛋白质稳定性的突变,如将核心区疏水氨基酸残基(Val、Leu 或 lle ) 突变成 Ala,可以用于严密性测试。

3.2 合成文库
( 1 ) 为了得到一个无偏倚的文库,首先要构建一个模板,用终止密码子替换基因插入区(可变区),同时插入移码(frame shift ) 和特定的限制性内切核酸酶位点以确保其明确鉴定(见注 1)。
( 2 ) 要得到每个文库,需要两个部分重叠(一般 18~20 bp) 的 PCR 产物。例如,对于 PCR 反应 1,使用的一条引物与载体的启动子区域(起始密码子上游 120 bp,图 15.4) 杂交互补,另一条引物与简并靶标的 5' 段互补。对于 PCR 反应 2,需要一条双臂引物和一条与 F[ 1,2] ( 可读框 3' 下游 120 bp 处,图 15.4) 杂交的引物。通常,PCR 反应程序设置如下:94°C 热起 1 min;然后,94°C 30s,52°C 30s,72°C 30s ( 见注 2),共 25 个循环;最后,72°C 延伸 10 min 以确保延伸完全。
( 3 ) PCR 产物进行琼脂糖凝胶电泳分析,使用 Gelstar 和 Dark reader(见注 3 ) 观察琼脂糖凝胶上的 PCR 产物,这里使用的是 400~500 nm 的蓝光,此波长对 DNA 没有损伤。如果得到目的条带,将剩余的 PCR 产物用于切胶回收。
( 4 ) 使用 QiaexTMII 纯化切胶产物(见注 4 )。
( 5 ) 将来源于 PCR 反应 1 和 2 的产物约 300 ng 混合(图 15.4 和注 5),加入 0.2 μmol/L 的末端引物(分别与启动子区和 F [ 1,2 ] 互补)分别与 PCR 反应 1 和 2 的 5' 端和 3' 端退火。PCR 反应 3 程序如下:94°C 热起 1 min;然后,94°C 20s,52°C 30s,72°C 30s,共 10 个循环;最后,72°C 延伸 10 min 以确保延伸完全(见注 6 )。
( 6 ) 使用合适的限制性内切核酸酶(此例是 SphI 和 XhoI ) 酶切以上得到的 PCR 产物和载体 pQE-32△F [ 1,2 ] ( 见注 7)。
( 7 ) 纯化酶切产物同第(4 ) 步。

3.3 文库的克隆和回收
( 1 ) 插入片段和载体的理想比例是(2 : 1 ) ~(3 : 1 )。我们将用于连接的 DNA 浓度限制在 10 ng/μl,使用 1 mmol/L 的 ATP,16°C 连接过夜(见注 8 )。
( 2 ) 连接反应体系于 65°C 处理,使酶失活,用氯仿抽提,然后用乙醇沉淀,得到的 DNA 放置几分钟风干,最后用 30 μl 去离子水重悬。
( 3 ) 同一天还要制作 SS 320 大肠杆菌细胞株(见注 9 ) 的电转感受态(见 15.3.8)。第(2 ) 步得到的连接产物与 300 μl SS320 细胞混合,加入至槽宽 2 mm 的电转杯,使用 GenepulserTMII 进行电转化。将仪器参数设定如下:2.5 kV,25 μF,200~400Ω。为了得到最好的结果,时间常数对应 200Ω 时应设为 3.8~4.5,400Ω 时应设为 7.6~9.0。脉冲后立即加入 1 ml 预冷的 SOC 培养基。将细胞转移至 15 ml 锥形管,用 SOC 培养基洗涤电转杯 2 次,最大限度地回收电转细胞,细胞在 37°C 适当转速下干 5 ml SOC 培养基中复苏 30 min。
( 4 ) 取适量电转细胞,稀释 104 倍,涂平板,菌落计数,用以衡量连接和克隆的效率(见注 10)。剩余细胞加入至 250 ml 的含合适添加剂的 LB 培养基中 [ 见 15.2.2 ( 9 ) ] 培养用于提取 DNA。
( 5 ) 使用 Qiagen Midiprep Kit 或其他类似碱裂解试剂盒提取 DNA [47] 。
3.4 文库筛选
( 1 ) 使用槽宽 1 mm 的电转杯,将 15.3.3(5) 得到的文库 100 ng 电转化到 65 μl 已经携带有质粒 pQE-32 ras-F [3] 的 BL21 pREP4 细胞中。仪器参数:1.25~1.6 kV,25 μF,200 Ω。时间参数对应于 GenepulserTM II 时设为 3.7~4.2,对应于 Electroporator 2510 时设为 4.0~4.6。细胞在 37°C SOC 培养基中复苏 30 min。
( 2 ) 用 PBS 洗细胞 2 次以除去 SOC 培养基。
( 3 ) 将细胞涂布于 15.2.3 ( 6 ) 所述的选择性平板,30°C 培养 24~72 h ( 见注 12)。同时,另取出部分电转细胞,稀释 103 倍涂平板,用于计数和与阳性对照比较,估算转化效率和文库克隆的细胞存活率。例如,我们同时转化相同量的表达野生型 RBD 与 F [ 1,2 ] 融合蛋白的载体,将电转细胞稀释 104~105 倍涂平板。在每一步的操作中,所有的测量都要避免文库与野生型正对照的交叉污染。
3.5 克隆竞争实验
改编自参考文献 [32]。
( 1 ) 经过适当时间的培养,用少量的选择培养基回收 15.3.4 ( 3 ) 平板中的细胞,加入到 25 ml 选择培养基中,30°C 250 r/min 培养。
( 2 ) 培养 24 h 后,取 1 μl 饱和培养物稀释至 2 ml 新鲜选择培养基中。
( 3 ) 可以重复第 ( 2 ) 步直至文库达到目标丰度。正常情况下,12 代(12 D ) 后,文库在很大程度上得以浓缩。但是,这对于不同的系统是不同的,受到各种因素的影响,如文库的简并性和严密性突变体的使用(见 15.3.1.2)。
( 4 ) 在任何一步,都可以将饱和培养物稀释 104~105 倍涂于选择性平板上,以定性检测竞争效率。随着连续竞争的进行,菌落间的大小差异将逐步减小,菌落的平均大小将增加。
( 5 ) 在任何一代,都可以取出 10 μl 文库加入 2 ml LB ( 100 μg/ml 氨苄青霉素,25 μg/ml 卡那霉素)培养过夜,然后使用 QIAprep 提取文库中的克隆的 DNA ( 见注 14)。
3.6 克隆的分离与测序
以下步骤既适用于提取文库中所含的独立克隆的质粒,也适用于上述操作中质粒混合物的提取。
( 1 ) 从克隆库中取出 300 ng DNA,加入限制性内切核酸酶消化,所用限制性内切核酸酶位点在 pREP4 和 pQE-32 ras-F[ 3 ] 质粒中存在,但在文库载体中不存在。基于此目的,我们使用 Xmal、EcoNI 和 Xba l ( 见注 15)。
( 2 ) 取 1/10 的酶切产物,转化 XL- 1 Blue 感受态细胞,取 20 μl 涂布含 100 μg/ml 氨苄青霉素的 LB 平板(见注 15)。
( 3 ) 挑菌落于含 100 μg/ml 氨苄青霉素的 LB 中培养。
( 4 ) 提取高质量的 DNA 用于测序。若操作 96 个样品,使用 MontageTMkit;样品数量少,适用 QIAprep column kit。
( 5 ) 我们使用只能和文库质粒退火(如 F [ 1,2 ] 内部序列)的引物进行测序(见注16 )。
( 6 ) 测序。
3.7 蛋白质提纯及其性质检测
分析测序结果,选择感兴趣的克隆排列在 96 孔板的合适位置。此时,克隆可以转化 XL-1 Blue 细胞,冻存作为备份。
( 1 ) 选中的克隆重新构建,只与 6X His tag 融合并表达蛋白质(见注 17)。诱导检测 6X His 克隆的表达(见注 18)。
( 2 ) 提取正确表达的克隆的质粒。
( 3 ) 转化 BL21 pREP4 细胞,涂布含 100 μg/ml 氨苄青霉素和 25 μg/ml 卡那霉素的平板,37°C 培养过夜。若平行操作多个克隆,可以使用 24 孔板。本例中,每个转化所用感受态细胞不要超过 20 μl,每平板最多也只涂 20 μl。涂板若超过最大允许体积,细胞将不能完全被培养基吸收。
( 4 ) 次日,挑菌落于 2.5 ml 含合适抗生素的 LB 中 37°C 培养过夜(见注 19)。
( 5 ) 以 1 :10 的比例将饱和培养物加入 25 ml 含合适抗生素的 TB 培养基中(见注 20)。
( 6 ) 加入 IPTG 至终浓度为 1 mmol/L,37°C 培养 90~120 min,收获细胞直接提取蛋白质或 -80°C 保存(见注 21)。
( 7 ) 细胞用 1 ml Buffer A [ 见 15.2.6 ( 8 ) ] 重悬,然后重新排列在 96 孔板中(见注 22)。3200 g 离心 40 min,去除大部分不可溶组分。
( 8 ) 0.2 μm 96 孔 PVDF 板中含有 200 μl 50% 的 Ni-NTA Superflow 树脂。将体积扩增器安装于 0.25 mm 的 96 孔玻命纤维过滤板上方,再将此装置安装在真空歧管的密封块上(见注 23)。然后,在第一个过滤板中加入 900 μl 样品,再加入 100 μl 乙醇以减小交叉感染的风险。用大约 500 mbar 的压力抽滤直至所有样品全部通过此板(见注 24)。
( 9 ) 现在 PVDF 板应含有树脂和样品抽提物。停止抽滤,从收集器上取下 PVDF 板,安装在真空歧管的密封块上,然后用大约 100 mbar 的压力抽滤直至所有样品全部通过树脂(见注 25)。
( 10 ) 用 800 μl Buffer B 洗 2 次 [ 见 15.2.6 (9) ],每次真空压力设为 500 mbar ( 见注 26)。
( 11 ) 放置好收集器,在 100 mbar 的压力下用 100 μl Buffer E 洗脱样品 4 次 [ 见 15.2.6 ( 10 ) 和注 26]。加入 1 mmol/L DTT 并将 pH 调至 5 ( 见注 27)。至此,样品可以直接用于性质检测(见注 28)。
3.8 制备 SS 320 和 BL21 pREP4 pQE-32 ras-F [ 3 ] 感受态细胞
按参考文献 [ 48 ] 方法准备细胞。
( 1 ) 挑 SS320 或 BL21 pREP4 pQE-32 ras-F 单克隆于 5 ml LB 或 5 ml SOB 培养基中,37°C 培养 5 h 到过夜。
( 2 ) 取 2.5 ml 培养物加入至 500 ml LB 或 500 ml SOB 培养基中,37°C 300 r/min 培养到 OD600 为 0.5~0.7。
( 3 ) 冰浴 10~15 min 然后转移至预冷的 1 L 离心瓶中。
( 4 ) 5000 g 离心 20 min。
( 5 ) 弃上清液,用 5 ml 冰水重悬菌体,加入 500 ml 冰水混匀,离心同第(4 ) 步。
( 6 ) 立即弃上清液,用剩余液体重悬菌体。
( 7 ) 再加入 500 ml 冰水混匀,离心同第(4 ) 步。
( 8 ) 立即弃上清液,用剩余液体重悬菌体。
( 9 ) 若细胞用于电转化,将重悬细胞转移至预冷的 50 ml 离心管,2°C 5000 g 离心 10 min。估算菌体体积(一般 500 ml 培养物会得到 500 μl ),在冰上加入相同体积的预冷水重悬细胞。Aliquot 50~300 μl 细胞至预冷的离心管中,细胞密度大约是 2X 1011 个细胞/ml。
( 10 ) 若要冻存电转化细胞,在第(8 ) 步得到的细胞中加入 40 ml 预冷的 10% 甘油并混匀。离心细胞同第(9 ) 步,估算菌体体积,在冰上加入相同体积的预冷 10% 甘油重悬细胞。Aliquot 50~300 μl 细胞至预冷的离心管中用干冰冷冻,-80°C 储存。
3.9 制备 XL-1 Blue 和 BL21 pREP4 感受态细胞
按照参考文献 [ 49 ] 方法准备细胞,稍作改动如下:细胞在第一次离心后仅洗 1 次,4°C 倒置离心瓶于纸上,除去痕量的培养基(见注 29)。
( 1 ) 在 200 ml SOB 或 LB 培养基中加入过夜培养物,18℃(200~250 r/min)培养至 OD600 约 0.6。
( 2 ) 冰浴 10 min 并转移至 500 ml 离心瓶。
( 3 ) 4°C 2500 g 离心 1 min。
( 4 ) 用 80 ml 预冷转化缓冲液重悬菌体,并冰浴 10 min,离心同(3 )。
( 5 ) 用 20 ml 预冷转化缓冲液轻柔的重悬,加入 DMSO 至终浓度为 7%。
( 6 ) 冰浴 10 min。
( 7 ) Aliquot 细胞重悬物,液氮冷冻。
3.1.1 PCA 对空间排列的要求
PCA 片段的三维朝向对于 PCA 报告蛋白是否能正确折叠至关重要,它取决于形成复合体的目的蛋白 N 端或 C 端的朝向(图 15.1 示意了在连接设计中对空间位置的考虑)。因此,在设计蛋白一PCA 片段融合体时,以何种方式将蛋白质片段连接在一起使其能够折叠形成天然结构是非常重要的。融合蛋白能否正确折叠受融合蛋白的末端朝向和片段间接头(linker) 长度两个因素的影响。我们将片段 GGGGS 应用于多种不同蛋白质,证明这个序列在大肠杆菌、酵母和哺乳动物细胞表达系统中效果都比较好。我们认为这个序列可以改善融合蛋白的弹性和可溶性,从而有利于其组装,而且由于此序列中不含天然蛋白酶识别位点,确保了融合蛋白的稳定性。虽然此类的接头受到青睐,但并不表示使用它就一定能得到可以互补的片段 [ 31,32,39] 。然而,还是要避免使用诸如脯氨酸和分支氨基酸类的大的疏水和刚性氨基酸。在大多数蛋白质工程的问题中,形成复合体的目的蛋白的三维结构是已知的,因此可以设计复合体的方向并计算出所需接头的长度。对于 DHFR PCA 来说,融合蛋白 N 端和 C 端的空间构象需求是已知的 [ 31,44 ] 。例如,如果将目的蛋白分别与F[ 1 ,2 ] 的 C 端和 F[ 3 ] 的 N 端融合,那么构建时所需的接头就可以很短甚至不需要,因为这种构建方法已经考虑到了 DHFR 的拓扑结构;但是如果将目的蛋白分别构建到两个片段的 N 端,要使 DNFR 能正确组装,就必须在两个融合蛋白之间插入至少两个氨基酸作为接头(每个肽键大约 3.75 A ) ,因为 DNFR 两个片段 N 端的距离将近 10A。在 ras 和 RBD 的例子中就选择了这种构建方式。然而,观察 raf RBD 与 ras 髙类似蛋白 raplA 的复合体结构发现这两个蛋白质的 C 端距离 40A,这就需要在每个融合蛋白中插入至少 6 个氨基酸的接头。对于文库筛选来说,我们将每个接头的总长度定为 14 个氨基酸,其中包括限制性内切核酸酶位点,以确保融合蛋白具有足够的灵活性。

3.1.2 对照和严密性
在利用 DHFR PCA 进行蛋白质工程研究和文库筛选之前,必须做严格的对照实验用以估计其对特定的测试系统的灵敏度和严密性。理想条件下,在进行文库筛选前,实验者应大概了解 PCA 对于一个给定的相互作用体的解离常数 Kd 的极限。不同的相互作用蛋白对有着不同的灵敏度极限(PCA 可以检测到的最大 Kd ),但是 Kd 值又受到融合蛋白表达水平、蛋白质表达总量中可溶蛋白比例以及诸如稳定性、可溶性和蛋白质折叠、结合参数等蛋白质自身性质的影响。如果 PCA 十分灵敏,可以检测到两个特定蛋白质间非常弱的相互作用,它就不能在众多的克隆中选出最好的相互作用蛋白对;也就是说,此项实验过于灵敏从而丧失了严密性。因此,平衡灵敏度和严密性的关系至关重要。为了解决这一问题,在 PCA 实验前通常需要做些对照实验,虽然不是所有的这些对照都与特定的蛋白质工程研究相关,我们在后面还会再讨论这个问题。
( 1 ) 伪组装(spurious reassembly): 要使 PCA 能有效工作,应避免片段间微弱的或非特异性的相互作用。对于一个给定的相互作用蛋白对测试系统来说,PCA 有效的灵敏度可以通过对照 4 和 6 来估算。如果灵敏度过高,如长出不该有相互作用的蛋白对的菌落(图 15.2A ) ,可以通过降低表达水平或通过对照 2 中所述的严密性突变来降低灵敏度(图 15.2B)。
( 2 ) 严密性突变(stringency mutant):突变 DHFR 两片段相互作用表面上的氨基酸残基侧链的效果,如已报道的 F[ 3 ] 的 I114A 突变。在克隆表达通过形成亮氨酸拉链 ( leucin zipper) 而相互作用的蛋白对时,菌落生长速度和数量无法区分不同蛋白对间的结合效率。后来,在 F[ 3 ] 中引入突变 I114A,改变了 PCA 的灵敏度,使其可以应用于亮氨酸拉链系统。这种灵敏度的变化可以通过一步筛选的选择因子(selection factor) 来衡量,选择因子等于共转化细胞数除以在选择压力下存活菌落数。数值越高严密性越高,所以在合理数量的重复竞争下,可以挑选出最好的相互作用亮氨酸拉链异源二聚体 [32]。

( 3 ) 片段置换(fragment sw apping):无论将相互作用的两个蛋白质分别与 PCA 系统的哪个片段融合,理论上应不影响两个目的蛋白的相互作用。因此,置换与两个目的蛋白质融合的片段应得到类似可比的结果。
( 4 ) 无相互作用蛋白质(noninteracting protein) : 如果已知一个蛋白质不和任何一个用于 PCA 测试的目的蛋白有相互作用,理应检测不到 PCA 反应(图 15.2A ) ,并且单独过量表达这个蛋白质也不会对已知的相互作用有竞争影响。
( 5 ) 通过竞争实验滴定和降低报告蛋白的酶活:报告蛋白的活性应随着两个融合蛋白表达比例的变化而改变;而且同时单独过量表达相互作用蛋白的其中之一应减弱 PCA 反应的活性。然而,应谨记每个融合蛋白相应的可溶性和稳定性、相互作用蛋白质间的亲和力对比它们的胞内浓度以及 PCA 的灵敏度都会对 titrate 报告蛋白的活性造成影响。因而可以通过降低融合蛋白的表达水平或整合对照 2 和对照 6 来调节报告蛋白的活性,从而降低互补效率。
( 6 ) 破坏相互作用:可以预测,在形成复合体的一个单体中插入特定的点突变或删除突变破坏或减弱目的蛋白相互作用力也会影响 PCA 反应。
如果蛋白质工程项目中用于研究的模型性质已经相当清楚,那么只有对照 1、对照 2、对照 4 和对照 6 对于确定实验的特异性和准确性是必需的。RBD-ras 的互补突变实验及突变对亲和常数 Kd 的影响已有相关报道,基于这些数据我们构建了若干突变,使 RBD-ras 相互作用的 Kd 值降低了三个数量级(图 15.3 例子)。我们将这些突变体和其他突变体都用于 DHFR-PCA 测试,以确保这项实验可以在 1 μmol/L 的数量级上检测到 RBD 与 ras 的相互作用。另外,已发表的降低蛋白质稳定性的突变,如将核心区疏水氨基酸残基(Val、Leu 或 lle ) 突变成 Ala,可以用于严密性测试。

3.2 合成文库
( 1 ) 为了得到一个无偏倚的文库,首先要构建一个模板,用终止密码子替换基因插入区(可变区),同时插入移码(frame shift ) 和特定的限制性内切核酸酶位点以确保其明确鉴定(见注 1)。
( 2 ) 要得到每个文库,需要两个部分重叠(一般 18~20 bp) 的 PCR 产物。例如,对于 PCR 反应 1,使用的一条引物与载体的启动子区域(起始密码子上游 120 bp,图 15.4) 杂交互补,另一条引物与简并靶标的 5' 段互补。对于 PCR 反应 2,需要一条双臂引物和一条与 F[ 1,2] ( 可读框 3' 下游 120 bp 处,图 15.4) 杂交的引物。通常,PCR 反应程序设置如下:94°C 热起 1 min;然后,94°C 30s,52°C 30s,72°C 30s ( 见注 2),共 25 个循环;最后,72°C 延伸 10 min 以确保延伸完全。
( 3 ) PCR 产物进行琼脂糖凝胶电泳分析,使用 Gelstar 和 Dark reader(见注 3 ) 观察琼脂糖凝胶上的 PCR 产物,这里使用的是 400~500 nm 的蓝光,此波长对 DNA 没有损伤。如果得到目的条带,将剩余的 PCR 产物用于切胶回收。
( 4 ) 使用 QiaexTMII 纯化切胶产物(见注 4 )。
( 5 ) 将来源于 PCR 反应 1 和 2 的产物约 300 ng 混合(图 15.4 和注 5),加入 0.2 μmol/L 的末端引物(分别与启动子区和 F [ 1,2 ] 互补)分别与 PCR 反应 1 和 2 的 5' 端和 3' 端退火。PCR 反应 3 程序如下:94°C 热起 1 min;然后,94°C 20s,52°C 30s,72°C 30s,共 10 个循环;最后,72°C 延伸 10 min 以确保延伸完全(见注 6 )。
( 6 ) 使用合适的限制性内切核酸酶(此例是 SphI 和 XhoI ) 酶切以上得到的 PCR 产物和载体 pQE-32△F [ 1,2 ] ( 见注 7)。
( 7 ) 纯化酶切产物同第(4 ) 步。

3.3 文库的克隆和回收
( 1 ) 插入片段和载体的理想比例是(2 : 1 ) ~(3 : 1 )。我们将用于连接的 DNA 浓度限制在 10 ng/μl,使用 1 mmol/L 的 ATP,16°C 连接过夜(见注 8 )。
( 2 ) 连接反应体系于 65°C 处理,使酶失活,用氯仿抽提,然后用乙醇沉淀,得到的 DNA 放置几分钟风干,最后用 30 μl 去离子水重悬。
( 3 ) 同一天还要制作 SS 320 大肠杆菌细胞株(见注 9 ) 的电转感受态(见 15.3.8)。第(2 ) 步得到的连接产物与 300 μl SS320 细胞混合,加入至槽宽 2 mm 的电转杯,使用 GenepulserTMII 进行电转化。将仪器参数设定如下:2.5 kV,25 μF,200~400Ω。为了得到最好的结果,时间常数对应 200Ω 时应设为 3.8~4.5,400Ω 时应设为 7.6~9.0。脉冲后立即加入 1 ml 预冷的 SOC 培养基。将细胞转移至 15 ml 锥形管,用 SOC 培养基洗涤电转杯 2 次,最大限度地回收电转细胞,细胞在 37°C 适当转速下干 5 ml SOC 培养基中复苏 30 min。
( 4 ) 取适量电转细胞,稀释 104 倍,涂平板,菌落计数,用以衡量连接和克隆的效率(见注 10)。剩余细胞加入至 250 ml 的含合适添加剂的 LB 培养基中 [ 见 15.2.2 ( 9 ) ] 培养用于提取 DNA。
( 5 ) 使用 Qiagen Midiprep Kit 或其他类似碱裂解试剂盒提取 DNA [47] 。
3.4 文库筛选
( 1 ) 使用槽宽 1 mm 的电转杯,将 15.3.3(5) 得到的文库 100 ng 电转化到 65 μl 已经携带有质粒 pQE-32 ras-F [3] 的 BL21 pREP4 细胞中。仪器参数:1.25~1.6 kV,25 μF,200 Ω。时间参数对应于 GenepulserTM II 时设为 3.7~4.2,对应于 Electroporator 2510 时设为 4.0~4.6。细胞在 37°C SOC 培养基中复苏 30 min。
( 2 ) 用 PBS 洗细胞 2 次以除去 SOC 培养基。
( 3 ) 将细胞涂布于 15.2.3 ( 6 ) 所述的选择性平板,30°C 培养 24~72 h ( 见注 12)。同时,另取出部分电转细胞,稀释 103 倍涂平板,用于计数和与阳性对照比较,估算转化效率和文库克隆的细胞存活率。例如,我们同时转化相同量的表达野生型 RBD 与 F [ 1,2 ] 融合蛋白的载体,将电转细胞稀释 104~105 倍涂平板。在每一步的操作中,所有的测量都要避免文库与野生型正对照的交叉污染。
3.5 克隆竞争实验
改编自参考文献 [32]。
( 1 ) 经过适当时间的培养,用少量的选择培养基回收 15.3.4 ( 3 ) 平板中的细胞,加入到 25 ml 选择培养基中,30°C 250 r/min 培养。
( 2 ) 培养 24 h 后,取 1 μl 饱和培养物稀释至 2 ml 新鲜选择培养基中。
( 3 ) 可以重复第 ( 2 ) 步直至文库达到目标丰度。正常情况下,12 代(12 D ) 后,文库在很大程度上得以浓缩。但是,这对于不同的系统是不同的,受到各种因素的影响,如文库的简并性和严密性突变体的使用(见 15.3.1.2)。
( 4 ) 在任何一步,都可以将饱和培养物稀释 104~105 倍涂于选择性平板上,以定性检测竞争效率。随着连续竞争的进行,菌落间的大小差异将逐步减小,菌落的平均大小将增加。
( 5 ) 在任何一代,都可以取出 10 μl 文库加入 2 ml LB ( 100 μg/ml 氨苄青霉素,25 μg/ml 卡那霉素)培养过夜,然后使用 QIAprep 提取文库中的克隆的 DNA ( 见注 14)。
3.6 克隆的分离与测序
以下步骤既适用于提取文库中所含的独立克隆的质粒,也适用于上述操作中质粒混合物的提取。
( 1 ) 从克隆库中取出 300 ng DNA,加入限制性内切核酸酶消化,所用限制性内切核酸酶位点在 pREP4 和 pQE-32 ras-F[ 3 ] 质粒中存在,但在文库载体中不存在。基于此目的,我们使用 Xmal、EcoNI 和 Xba l ( 见注 15)。
( 2 ) 取 1/10 的酶切产物,转化 XL- 1 Blue 感受态细胞,取 20 μl 涂布含 100 μg/ml 氨苄青霉素的 LB 平板(见注 15)。
( 3 ) 挑菌落于含 100 μg/ml 氨苄青霉素的 LB 中培养。
( 4 ) 提取高质量的 DNA 用于测序。若操作 96 个样品,使用 MontageTMkit;样品数量少,适用 QIAprep column kit。
( 5 ) 我们使用只能和文库质粒退火(如 F [ 1,2 ] 内部序列)的引物进行测序(见注16 )。
( 6 ) 测序。
3.7 蛋白质提纯及其性质检测
分析测序结果,选择感兴趣的克隆排列在 96 孔板的合适位置。此时,克隆可以转化 XL-1 Blue 细胞,冻存作为备份。
( 1 ) 选中的克隆重新构建,只与 6X His tag 融合并表达蛋白质(见注 17)。诱导检测 6X His 克隆的表达(见注 18)。
( 2 ) 提取正确表达的克隆的质粒。
( 3 ) 转化 BL21 pREP4 细胞,涂布含 100 μg/ml 氨苄青霉素和 25 μg/ml 卡那霉素的平板,37°C 培养过夜。若平行操作多个克隆,可以使用 24 孔板。本例中,每个转化所用感受态细胞不要超过 20 μl,每平板最多也只涂 20 μl。涂板若超过最大允许体积,细胞将不能完全被培养基吸收。
( 4 ) 次日,挑菌落于 2.5 ml 含合适抗生素的 LB 中 37°C 培养过夜(见注 19)。
( 5 ) 以 1 :10 的比例将饱和培养物加入 25 ml 含合适抗生素的 TB 培养基中(见注 20)。
( 6 ) 加入 IPTG 至终浓度为 1 mmol/L,37°C 培养 90~120 min,收获细胞直接提取蛋白质或 -80°C 保存(见注 21)。
( 7 ) 细胞用 1 ml Buffer A [ 见 15.2.6 ( 8 ) ] 重悬,然后重新排列在 96 孔板中(见注 22)。3200 g 离心 40 min,去除大部分不可溶组分。
( 8 ) 0.2 μm 96 孔 PVDF 板中含有 200 μl 50% 的 Ni-NTA Superflow 树脂。将体积扩增器安装于 0.25 mm 的 96 孔玻命纤维过滤板上方,再将此装置安装在真空歧管的密封块上(见注 23)。然后,在第一个过滤板中加入 900 μl 样品,再加入 100 μl 乙醇以减小交叉感染的风险。用大约 500 mbar 的压力抽滤直至所有样品全部通过此板(见注 24)。
( 9 ) 现在 PVDF 板应含有树脂和样品抽提物。停止抽滤,从收集器上取下 PVDF 板,安装在真空歧管的密封块上,然后用大约 100 mbar 的压力抽滤直至所有样品全部通过树脂(见注 25)。
( 10 ) 用 800 μl Buffer B 洗 2 次 [ 见 15.2.6 (9) ],每次真空压力设为 500 mbar ( 见注 26)。
( 11 ) 放置好收集器,在 100 mbar 的压力下用 100 μl Buffer E 洗脱样品 4 次 [ 见 15.2.6 ( 10 ) 和注 26]。加入 1 mmol/L DTT 并将 pH 调至 5 ( 见注 27)。至此,样品可以直接用于性质检测(见注 28)。
3.8 制备 SS 320 和 BL21 pREP4 pQE-32 ras-F [ 3 ] 感受态细胞
按参考文献 [ 48 ] 方法准备细胞。
( 1 ) 挑 SS320 或 BL21 pREP4 pQE-32 ras-F 单克隆于 5 ml LB 或 5 ml SOB 培养基中,37°C 培养 5 h 到过夜。
( 2 ) 取 2.5 ml 培养物加入至 500 ml LB 或 500 ml SOB 培养基中,37°C 300 r/min 培养到 OD600 为 0.5~0.7。
( 3 ) 冰浴 10~15 min 然后转移至预冷的 1 L 离心瓶中。
( 4 ) 5000 g 离心 20 min。
( 5 ) 弃上清液,用 5 ml 冰水重悬菌体,加入 500 ml 冰水混匀,离心同第(4 ) 步。
( 6 ) 立即弃上清液,用剩余液体重悬菌体。
( 7 ) 再加入 500 ml 冰水混匀,离心同第(4 ) 步。
( 8 ) 立即弃上清液,用剩余液体重悬菌体。
( 9 ) 若细胞用于电转化,将重悬细胞转移至预冷的 50 ml 离心管,2°C 5000 g 离心 10 min。估算菌体体积(一般 500 ml 培养物会得到 500 μl ),在冰上加入相同体积的预冷水重悬细胞。Aliquot 50~300 μl 细胞至预冷的离心管中,细胞密度大约是 2X 1011 个细胞/ml。
( 10 ) 若要冻存电转化细胞,在第(8 ) 步得到的细胞中加入 40 ml 预冷的 10% 甘油并混匀。离心细胞同第(9 ) 步,估算菌体体积,在冰上加入相同体积的预冷 10% 甘油重悬细胞。Aliquot 50~300 μl 细胞至预冷的离心管中用干冰冷冻,-80°C 储存。
3.9 制备 XL-1 Blue 和 BL21 pREP4 感受态细胞
按照参考文献 [ 49 ] 方法准备细胞,稍作改动如下:细胞在第一次离心后仅洗 1 次,4°C 倒置离心瓶于纸上,除去痕量的培养基(见注 29)。
( 1 ) 在 200 ml SOB 或 LB 培养基中加入过夜培养物,18℃(200~250 r/min)培养至 OD600 约 0.6。
( 2 ) 冰浴 10 min 并转移至 500 ml 离心瓶。
( 3 ) 4°C 2500 g 离心 1 min。
( 4 ) 用 80 ml 预冷转化缓冲液重悬菌体,并冰浴 10 min,离心同(3 )。
( 5 ) 用 20 ml 预冷转化缓冲液轻柔的重悬,加入 DMSO 至终浓度为 7%。
( 6 ) 冰浴 10 min。
( 7 ) Aliquot 细胞重悬物,液氮冷冻。
来源:丁香实验