材料与仪器
步骤
本文中描述的方法涵盖了变色子在细菌及真核细胞里的克隆与表达(见 4.3.1 ),变色子的生物化学和生物物理特征鉴定(见 4.3.2 ),以及通过 FRET 技术将变色子用于体内 Ca2+ 成像(见 4.3.3 )。
3.1 变色子的克隆
使用 5 个不同的部件:CFP、YFP、N-CaM、C-CaM 和 CRS,用标准的重组 DNA 方法 [8] 模块式组装钙变色子。 CFP 和 YFP 质粒可从 Clontech 购得;CaM 来自 Dr. Ikum;CRS 用寡核苷酸链反应合成。为制取钙变色子的 DNA 操控不在这里详细讲述,因为没有适合所有可能性的单一技术(见注 4)。钙变色子制成之后,融合片段克隆到 PRSETB 质粒中,以表达足够蛋白,完成生物化学和生物物理鉴定。我们把融合片段克隆到 pcDNA3 质粒中(见注 5),以供体内 Ca2+ 成像实验用的瞬时哺乳细胞表达。
3.2 生物化学和生物物理鉴定
钙变色子在能够用于体内 Ca2+ 成像之前,先提纯(见 4.3.2.1 和注 6 ) 并完成体内荧光实验,以确定其动态范围(见 4.3.2.2 ) 和钙离子结合曲线(见 4.3.2.3 )。
3.2.1 钙变色子从细菌细胞中提纯
( 1 ) 用标准的分子生物学方法以细菌质粒转染 BL21 ( DE3 ) 细胞 [8] 。
( 2 ) 把细胞平铺在含氨苄青霉素的 LB 平板上,37°C 保温过夜。
( 3 ) 选择一单菌落,37°C,在 100 ml 含 100 μmol/L 氨苄青霉素的 LB 培养液中生长。
( 4 ) 在 600 nm 光学密度为 0.7 时,用 0.5 mmol/L IPTG 诱导 3 h。
( 5 ) 以 3000 g 离心细胞 30 min。
( 6 ) 重悬细胞于 10 ml,pH 7.4,含 10% 甘油、100 mmol 氯化钾、1 mmol/L 氯化钙和 1 mmol/L 苯基甲基磺酰基氟化物的 50 mmol/L HEPES 中。
( 7 ) 用 0.5 英寸超声头以最大功率,10% 工作周期,超声 4 次,每次 4 min。两次超声之间,溶液降温 5 min。
( 8 ) 以 30000 g 离心细胞碎片 20 min。
( 9 ) 在 4°C 轻轻地混合上清液与 1 ml Ni-NTA 琼脂糖浆液 30 min。
( 10 ) 以 10 ml 含 100 mmol/L 氯化钾和 5 mmol/L 咪唑 pH 7.4 的 50 mmol/L HEPES 洗柱。
( 11 ) 用 1 ml 含 100 mmol/L 氯化钾和 100 mmol/L 咪唑的 50 mmol/L HEPES 洗脱。不需要切掉 His-tag,因为它并不干扰荧光特性。
( 12 ) 在 4°C,用 2 L 含 100 mmol/L 氯化钾,pH 7.4 的 50 mmol/L HEPES 透析样品。
3.2.2 荧光谱分析
FRET 效率的变化(或者,在钙变色子的情形下,Ca2+ 浓度的变化)常常可以从发射比的变化观察到(只为受体发射的峰值强度除以给体的峰值发射强度)。Ca2+ 指示子的动态范围定义为最大比率 Rmax 除以最小比率 Rmin。较大的动态范围在体内 Ca2+ 指示上更有效。
( 1 ) 在装有含 100 mmol/L 氯化钾,20 μmol/L EGTA 的 50 mmol/L HEPES 的 1 ml 试管中稀释样品。只要发射信号保持可测,任何稀释因子都可用。在 433 nm 激发下,记录从 450~570 nm 的荧光发射谱。
( 2 ) 记录空白样品的荧光发射谱。
( 3 ) 从 第(1 ) 步的记录中减去第(2 ) 步的记录,以得到在无 Ca2+ 条件下钙变色子的荧光谱。从这个谱中确定 Rmin。
( 4 ) 在 1 mmol/L Ca2+ 存在的条件下,重复(1 )~(3 ) 步,以确定 Ca2+ 存在时钙变色子的荧光谱。
( 5 ) 图4.3 显示 YC6.1 [ 5 ] 在加入 Ca2+ 之前和之后的荧光谱,及 Rmax 和 Rmin 分别为 1.1 和 2.4。

3.2.3 Ca2+ 结合性质
Ca2+ 结合曲线用来评估 Ca2+ 指示器能够测量的 [Ca2+] 的有效范围。Ca2+/EDTA 和 Ca2+/EGTA 缓冲液用来作为浓度标准,因为在低 [Ca2+] ,Ca2+ 污染会显著地扭曲空白 [Ca2+] 水平(见注 7) 。
( 1 ) 在 1 ml 试管中,用 EGTA 稀释样品。在 433 nm 激发下,记录从 450~570 nm 的荧光发射谱。确定激发比。
( 2 ) 为得到 Ca2+ 结合曲线,连续地加入氯化钙溶液到样品中,并测定发射比。因为本章描述的实验是在 20°C 的 EGTA 和氯化钙缓冲液中完成的,通过解下述二次方程 ( 如在不同条件下,请参考文献 [ 9 ] ) 可求得自由钙:

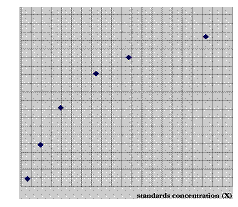
( 3 ) 为绘出 Ca2+ 结合曲线,将 [Ca2+] 对发射比作图。图 4.4 显示 YC6.1 的 Ca2+ 结合曲线。

3.3 用钙变色子使 Ca2+ 成像
本节描述简单的 HeLa 细胞中 Ca2+ 成像实验;但是只需很小的修正,此方法可应用于其他的黏着细胞和生理条件。分别描述细胞培养液制备(见 4.3.3.1 ) 和数据采集 ( 见 4.3.3.2 ) 。
3.3.1 细胞培养液制备
( 1 ) 把 HeLa 细胞铺在装有 DMEM-10%FBS 培养液的直径为 35 mm 的玻璃皿上。
( 2 ) 在 37°C ( 5% 二氧化碳)保育,直到 50%~80% 细胞汇合。
( 3 ) 使用 Genejuice ( Novagen) ,将含钙变色子的哺乳细胞表达质粒转染细胞。
( 4 ) 6 h 以后移除转染混合液,代之以 1.5 ml 的 DMEM-10%FBS 培养液。
( 5 ) 在 37°C ( 5% 二氧化碳)保育 24 h。能完成 Ca2+ 成像实验的细胞已备好。
4.3.3.2 数据采集
实验应该在暗室中完成,以减少背景光。图 4.5 显示我们使用的显微设备。

( 1 ) 打开氙灯、显微镜、滤光转换器和计算机。
( 2 ) 从培养皿中移除培养基。
( 3 ) 用 1 ml HBSS ( + 氯化钙)清洗。
( 4 ) 加入 1 ml 新鲜的 HBSS ( + 氯化钙)。
( 5 ) 把细胞放在显微镜台面上。
( 6 ) 启动 Meta Fluor 软件。在采集数据时,Meta Fluor 软件控制快门、滤光转换器和照相机。
( 7 ) 用目镜挑选 YFP 荧光,以发现表达钙变色子的细胞。把滤光指示转到 U-WNIBA 带通直角镜位置,并根据荧光发射水平,使 ND 滤镜在 0.1%~10%。U-WNIBA 直角镜对使用目镜快速发现 YFP 荧光细胞很实用,而 10% ND 滤镜是用来防止光褪色。
( 8 ) 使用 40X 油物镜,把显微视场中心移到外观健康、并呈现强胞质体荧光的细胞上。图 4.6 是显示健康 HeLa细胞典型荧光分布的画面。
( 9 ) 用 Meta Fluor 在计算机荧屏上逐幅采集图像,同时调节聚焦直至得到最清晰的图像。
( 10 ) 把滤光指示转到 CFP-YFP FRET 直角镜位置。
( 11 ) 为监控作为 CFP 对时间的峰值激发的结果的 CFP 和 YFP 的峰值激发,课置如下数据采集条件:时间间隔大于 10s;对 CFP 和 YFP,曝光时间 200 ms。MetaFluor 会显示发射比随时间的变化。
( 12 ) 在 CCD 图像上选择一块感兴趣的区域。通常这个区域要涵盖感兴趣的细胞。然后开始数据采集。在感兴趣的区域内的 CFP 和 YFP 的荧光发射强度,和它们的发射比一起,会得到实时监控(见注 8 )。
( 13 ) 当发射比达到稳衡态,向培养皿中加入 50 μl 12 mmol/L 组胺,使终浓度大约为 100 μmol/L。操作过程要小心,不要移动培养皿。组胺结合到质膜上的受体上,启动信号级联,使 Ca2+ 从内质网通过肌糖-1,4,5-三磷酸受体释放 [ 10,11 ] 。这将会引起钙变色子的构象变化,因 YFP 发射强度增加 CFP 强度减弱而被观察到。因而,发射比应该增加。当组胺作用消退后,发射比应该减退到稳衡态水平。图 4.6 显示 Meta Fluor 软件在采集数据时的一幅荧屏照片。

( 14 ) 为使发射比与胞质体 [Ca2+] 相关联,必须测定 Rmin 和 Rmax,以便把发射比映射到 Ca2+ 结合曲线上。加 入 50 μl 的 20 μmol/L 离子霉素,使终浓度近似为 1 μmol/L。离子霉素在质膜上把通道打开,以让 Ca2+ 渗过。由于培养基的氯化钙饱和,发射比会升高到 Rmax。为测定 Rmin,加入 50 μl 100 mmol/L 的 EGTA 和 600 μmol/L BAPTA-AM,使终浓度分别近似为 5 mmol/L 和 30 μmol/L。发射比应该会降到 Rmin。
( 15 ) 停止数据采集。
3.1 变色子的克隆
使用 5 个不同的部件:CFP、YFP、N-CaM、C-CaM 和 CRS,用标准的重组 DNA 方法 [8] 模块式组装钙变色子。 CFP 和 YFP 质粒可从 Clontech 购得;CaM 来自 Dr. Ikum;CRS 用寡核苷酸链反应合成。为制取钙变色子的 DNA 操控不在这里详细讲述,因为没有适合所有可能性的单一技术(见注 4)。钙变色子制成之后,融合片段克隆到 PRSETB 质粒中,以表达足够蛋白,完成生物化学和生物物理鉴定。我们把融合片段克隆到 pcDNA3 质粒中(见注 5),以供体内 Ca2+ 成像实验用的瞬时哺乳细胞表达。
3.2 生物化学和生物物理鉴定
钙变色子在能够用于体内 Ca2+ 成像之前,先提纯(见 4.3.2.1 和注 6 ) 并完成体内荧光实验,以确定其动态范围(见 4.3.2.2 ) 和钙离子结合曲线(见 4.3.2.3 )。
3.2.1 钙变色子从细菌细胞中提纯
( 1 ) 用标准的分子生物学方法以细菌质粒转染 BL21 ( DE3 ) 细胞 [8] 。
( 2 ) 把细胞平铺在含氨苄青霉素的 LB 平板上,37°C 保温过夜。
( 3 ) 选择一单菌落,37°C,在 100 ml 含 100 μmol/L 氨苄青霉素的 LB 培养液中生长。
( 4 ) 在 600 nm 光学密度为 0.7 时,用 0.5 mmol/L IPTG 诱导 3 h。
( 5 ) 以 3000 g 离心细胞 30 min。
( 6 ) 重悬细胞于 10 ml,pH 7.4,含 10% 甘油、100 mmol 氯化钾、1 mmol/L 氯化钙和 1 mmol/L 苯基甲基磺酰基氟化物的 50 mmol/L HEPES 中。
( 7 ) 用 0.5 英寸超声头以最大功率,10% 工作周期,超声 4 次,每次 4 min。两次超声之间,溶液降温 5 min。
( 8 ) 以 30000 g 离心细胞碎片 20 min。
( 9 ) 在 4°C 轻轻地混合上清液与 1 ml Ni-NTA 琼脂糖浆液 30 min。
( 10 ) 以 10 ml 含 100 mmol/L 氯化钾和 5 mmol/L 咪唑 pH 7.4 的 50 mmol/L HEPES 洗柱。
( 11 ) 用 1 ml 含 100 mmol/L 氯化钾和 100 mmol/L 咪唑的 50 mmol/L HEPES 洗脱。不需要切掉 His-tag,因为它并不干扰荧光特性。
( 12 ) 在 4°C,用 2 L 含 100 mmol/L 氯化钾,pH 7.4 的 50 mmol/L HEPES 透析样品。
3.2.2 荧光谱分析
FRET 效率的变化(或者,在钙变色子的情形下,Ca2+ 浓度的变化)常常可以从发射比的变化观察到(只为受体发射的峰值强度除以给体的峰值发射强度)。Ca2+ 指示子的动态范围定义为最大比率 Rmax 除以最小比率 Rmin。较大的动态范围在体内 Ca2+ 指示上更有效。
( 1 ) 在装有含 100 mmol/L 氯化钾,20 μmol/L EGTA 的 50 mmol/L HEPES 的 1 ml 试管中稀释样品。只要发射信号保持可测,任何稀释因子都可用。在 433 nm 激发下,记录从 450~570 nm 的荧光发射谱。
( 2 ) 记录空白样品的荧光发射谱。
( 3 ) 从 第(1 ) 步的记录中减去第(2 ) 步的记录,以得到在无 Ca2+ 条件下钙变色子的荧光谱。从这个谱中确定 Rmin。
( 4 ) 在 1 mmol/L Ca2+ 存在的条件下,重复(1 )~(3 ) 步,以确定 Ca2+ 存在时钙变色子的荧光谱。
( 5 ) 图4.3 显示 YC6.1 [ 5 ] 在加入 Ca2+ 之前和之后的荧光谱,及 Rmax 和 Rmin 分别为 1.1 和 2.4。

3.2.3 Ca2+ 结合性质
Ca2+ 结合曲线用来评估 Ca2+ 指示器能够测量的 [Ca2+] 的有效范围。Ca2+/EDTA 和 Ca2+/EGTA 缓冲液用来作为浓度标准,因为在低 [Ca2+] ,Ca2+ 污染会显著地扭曲空白 [Ca2+] 水平(见注 7) 。
( 1 ) 在 1 ml 试管中,用 EGTA 稀释样品。在 433 nm 激发下,记录从 450~570 nm 的荧光发射谱。确定激发比。
( 2 ) 为得到 Ca2+ 结合曲线,连续地加入氯化钙溶液到样品中,并测定发射比。因为本章描述的实验是在 20°C 的 EGTA 和氯化钙缓冲液中完成的,通过解下述二次方程 ( 如在不同条件下,请参考文献 [ 9 ] ) 可求得自由钙:

( 3 ) 为绘出 Ca2+ 结合曲线,将 [Ca2+] 对发射比作图。图 4.4 显示 YC6.1 的 Ca2+ 结合曲线。

3.3 用钙变色子使 Ca2+ 成像
本节描述简单的 HeLa 细胞中 Ca2+ 成像实验;但是只需很小的修正,此方法可应用于其他的黏着细胞和生理条件。分别描述细胞培养液制备(见 4.3.3.1 ) 和数据采集 ( 见 4.3.3.2 ) 。
3.3.1 细胞培养液制备
( 1 ) 把 HeLa 细胞铺在装有 DMEM-10%FBS 培养液的直径为 35 mm 的玻璃皿上。
( 2 ) 在 37°C ( 5% 二氧化碳)保育,直到 50%~80% 细胞汇合。
( 3 ) 使用 Genejuice ( Novagen) ,将含钙变色子的哺乳细胞表达质粒转染细胞。
( 4 ) 6 h 以后移除转染混合液,代之以 1.5 ml 的 DMEM-10%FBS 培养液。
( 5 ) 在 37°C ( 5% 二氧化碳)保育 24 h。能完成 Ca2+ 成像实验的细胞已备好。
4.3.3.2 数据采集
实验应该在暗室中完成,以减少背景光。图 4.5 显示我们使用的显微设备。

( 1 ) 打开氙灯、显微镜、滤光转换器和计算机。
( 2 ) 从培养皿中移除培养基。
( 3 ) 用 1 ml HBSS ( + 氯化钙)清洗。
( 4 ) 加入 1 ml 新鲜的 HBSS ( + 氯化钙)。
( 5 ) 把细胞放在显微镜台面上。
( 6 ) 启动 Meta Fluor 软件。在采集数据时,Meta Fluor 软件控制快门、滤光转换器和照相机。
( 7 ) 用目镜挑选 YFP 荧光,以发现表达钙变色子的细胞。把滤光指示转到 U-WNIBA 带通直角镜位置,并根据荧光发射水平,使 ND 滤镜在 0.1%~10%。U-WNIBA 直角镜对使用目镜快速发现 YFP 荧光细胞很实用,而 10% ND 滤镜是用来防止光褪色。
( 8 ) 使用 40X 油物镜,把显微视场中心移到外观健康、并呈现强胞质体荧光的细胞上。图 4.6 是显示健康 HeLa细胞典型荧光分布的画面。
( 9 ) 用 Meta Fluor 在计算机荧屏上逐幅采集图像,同时调节聚焦直至得到最清晰的图像。
( 10 ) 把滤光指示转到 CFP-YFP FRET 直角镜位置。
( 11 ) 为监控作为 CFP 对时间的峰值激发的结果的 CFP 和 YFP 的峰值激发,课置如下数据采集条件:时间间隔大于 10s;对 CFP 和 YFP,曝光时间 200 ms。MetaFluor 会显示发射比随时间的变化。
( 12 ) 在 CCD 图像上选择一块感兴趣的区域。通常这个区域要涵盖感兴趣的细胞。然后开始数据采集。在感兴趣的区域内的 CFP 和 YFP 的荧光发射强度,和它们的发射比一起,会得到实时监控(见注 8 )。
( 13 ) 当发射比达到稳衡态,向培养皿中加入 50 μl 12 mmol/L 组胺,使终浓度大约为 100 μmol/L。操作过程要小心,不要移动培养皿。组胺结合到质膜上的受体上,启动信号级联,使 Ca2+ 从内质网通过肌糖-1,4,5-三磷酸受体释放 [ 10,11 ] 。这将会引起钙变色子的构象变化,因 YFP 发射强度增加 CFP 强度减弱而被观察到。因而,发射比应该增加。当组胺作用消退后,发射比应该减退到稳衡态水平。图 4.6 显示 Meta Fluor 软件在采集数据时的一幅荧屏照片。

( 14 ) 为使发射比与胞质体 [Ca2+] 相关联,必须测定 Rmin 和 Rmax,以便把发射比映射到 Ca2+ 结合曲线上。加 入 50 μl 的 20 μmol/L 离子霉素,使终浓度近似为 1 μmol/L。离子霉素在质膜上把通道打开,以让 Ca2+ 渗过。由于培养基的氯化钙饱和,发射比会升高到 Rmax。为测定 Rmin,加入 50 μl 100 mmol/L 的 EGTA 和 600 μmol/L BAPTA-AM,使终浓度分别近似为 5 mmol/L 和 30 μmol/L。发射比应该会降到 Rmin。
( 15 ) 停止数据采集。
来源:丁香实验