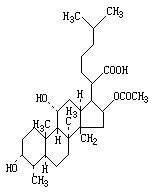
原理
从不同大肠杆菌菌株中获得的 P1 噬菌体 DNA 的产量与质量取决于宿主菌的基因型和重组子中外源 DNA 的特定序列。将 P1 或 PAC 重组子转化到不表达 Cre 重组酶的大肠杆菌菌株中有时可以解决低产或劣质的问题(如 NS3516; Sternberg et al. 1994)。
材料与仪器
步骤
一、材料
1. 酶与缓冲液
限制性内切核酸酶
2. 凝胶
琼脂糖凝胶
3. 培养基
含 25 μg/ml 卡那霉素的 LB 琼脂平板
SOC 培养基
含 25 μg/ml 卡那霉素的 TB 培养基
4. 专用设备
电穿孔仪
5. 载体和菌株
闭环重组 P1 DNA
冷冻保存的电转感受态大肠杆菌细胞(如 DH10B )
二、方法
1. 用无菌水将 2~3 μg P1 质粒 DNA 稀释至 60 ng/μl。设一不含 P1 DNA 的对照样品 (无菌水),在电穿孔时作为平行对照。.
2. 将电转感受态细胞置于冰上融化。预冷 0.1 cm 电穿孔杯。
3. 将 20 μl 细胞与 1 μl P1 DNA 在预冷的电穿孔杯中混合。
4. 将电穿孔仪设为 1.8 kV, 200 Ω,25 μF。
5. 电击细胞,最佳时间常数通常约为 5 ms。
6. 立即向细胞悬液中加入 0.5 ml 预热至 37℃ 的 SOC 培养基。将悬液转移至一培养管中,37℃ 中度振荡培养 1 h。
7. 将 100 μl 的细胞悬液涂布于含 25 μg/ml 卡那霉素的 LB 平板上,37℃ 温育过夜。
8. 将 10~12 个菌落分别置于 11 ml 含 25 μg/ml 卡那霉素的 TB 培养液中。37℃ 剧烈振荡,培养过夜。
9. 制备 P1 DNA。
10. 用不同限制性内切核酸酶进行酶切,经琼脂糖凝胶电泳比较新提取的 DNA 与原始重组子 DNA 的酶切图谱。
1. 酶与缓冲液
限制性内切核酸酶
2. 凝胶
琼脂糖凝胶
3. 培养基
含 25 μg/ml 卡那霉素的 LB 琼脂平板
SOC 培养基
含 25 μg/ml 卡那霉素的 TB 培养基
4. 专用设备
电穿孔仪
5. 载体和菌株
闭环重组 P1 DNA
冷冻保存的电转感受态大肠杆菌细胞(如 DH10B )
二、方法
1. 用无菌水将 2~3 μg P1 质粒 DNA 稀释至 60 ng/μl。设一不含 P1 DNA 的对照样品 (无菌水),在电穿孔时作为平行对照。.
2. 将电转感受态细胞置于冰上融化。预冷 0.1 cm 电穿孔杯。
3. 将 20 μl 细胞与 1 μl P1 DNA 在预冷的电穿孔杯中混合。
4. 将电穿孔仪设为 1.8 kV, 200 Ω,25 μF。
5. 电击细胞,最佳时间常数通常约为 5 ms。
6. 立即向细胞悬液中加入 0.5 ml 预热至 37℃ 的 SOC 培养基。将悬液转移至一培养管中,37℃ 中度振荡培养 1 h。
7. 将 100 μl 的细胞悬液涂布于含 25 μg/ml 卡那霉素的 LB 平板上,37℃ 温育过夜。
8. 将 10~12 个菌落分别置于 11 ml 含 25 μg/ml 卡那霉素的 TB 培养液中。37℃ 剧烈振荡,培养过夜。
9. 制备 P1 DNA。
10. 用不同限制性内切核酸酶进行酶切,经琼脂糖凝胶电泳比较新提取的 DNA 与原始重组子 DNA 的酶切图谱。
来源:丁香实验