蛋白多肽类药物递送有点难?需要怎么做?
逸微健华
外泌体由于其毒性小、免疫原性低、能穿透到机体深处成为药物递送极具潜力的载体。
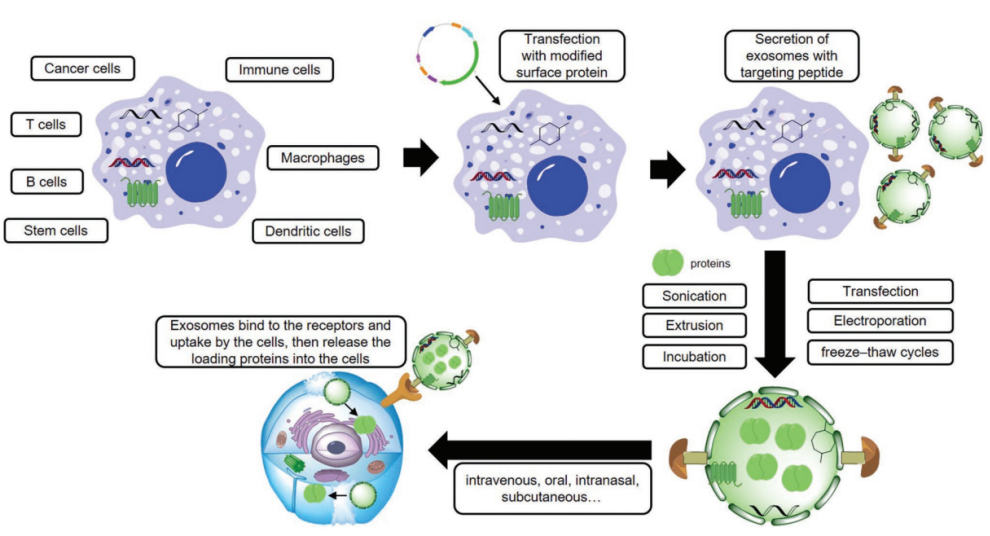
外泌体的药物递送:内源表达和外部装载。
内源表达:通过细胞内源表达,使蛋白或 RNA 等药物被分选进入 EVs。降低载药的难度,简单有效地实现药物装载;
外部装载: EVs 纯化后,通过机械或化学技术暂时打开 EVs 的膜,使化合物扩散到囊泡中。
1、亲本细胞过表达外源蛋白
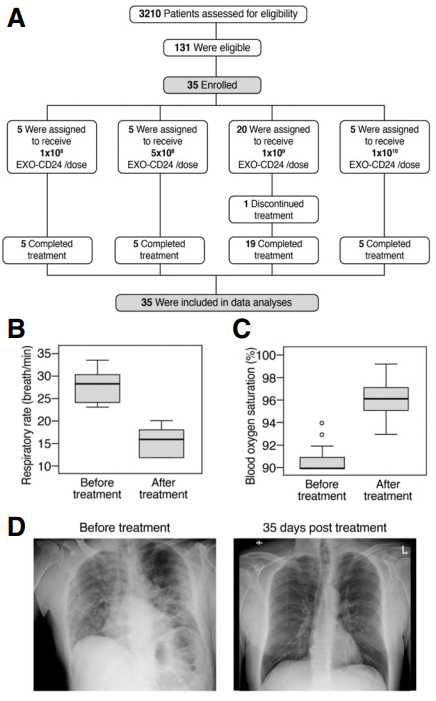
研究者开发了一种新的抗炎药-EXO-CD24能有效减少炎症标记物和细胞因子/趋化因子,它是免疫检查点(CD24)和传递平台(exosomes)的组合。
CD24过表达质粒转染到HEK293细胞中,并用四环素诱导CD24 在细胞中表达,收集高表达CD24的外泌体(EXO-CD24)。
2、利用外泌体上单跨膜支架蛋白融合表达外源蛋白
CD47通常在肿瘤细胞表面上调,与信号调节蛋白α(SIRPα)结合并抑制其吞噬功能,发出“不要吃我”的信号。HEK293细胞以血小板衍生生长因子受体(PDGFR)为支架蛋白,将重组SIRPα展示在外泌体表面(Exo-SIRPα),充当CD47的竞争性拮抗剂。研究者发现Exo-SIRPα有效地拮抗癌细胞上的CD47“不要吃我”信号,在体外增强BMDM对肿瘤细胞的吞噬作用,并抑制肿瘤异种移植物的生长。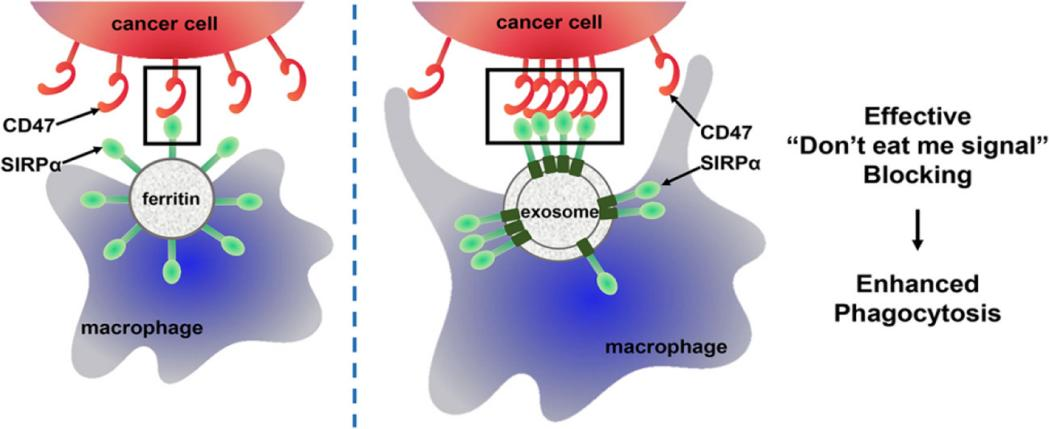
3、利用四跨膜蛋白进行膜外递送
杜氏肌营养不良症(DMD)是一种由功能性肌营养不良蛋白丢失引起的破坏性疾病。血清稳定性低,对DMD的疗效有限。以小鼠成纤维细胞为亲本细胞,将肌抑素前肽的抑制结构域融合到CD63的第二个膜外环中,将前肽的抑制结构域锚定在外泌体(EXOpro)表面,提高血清稳定性,递送效率和功效。重复给予EXOpro加速了肌肉再生和生长,恢复肌肉质量和功能恢复显著增加,EXOpro部分康复了DMD模型小鼠的骨骼结构并促进了骨再生且小鼠体内没有毒性。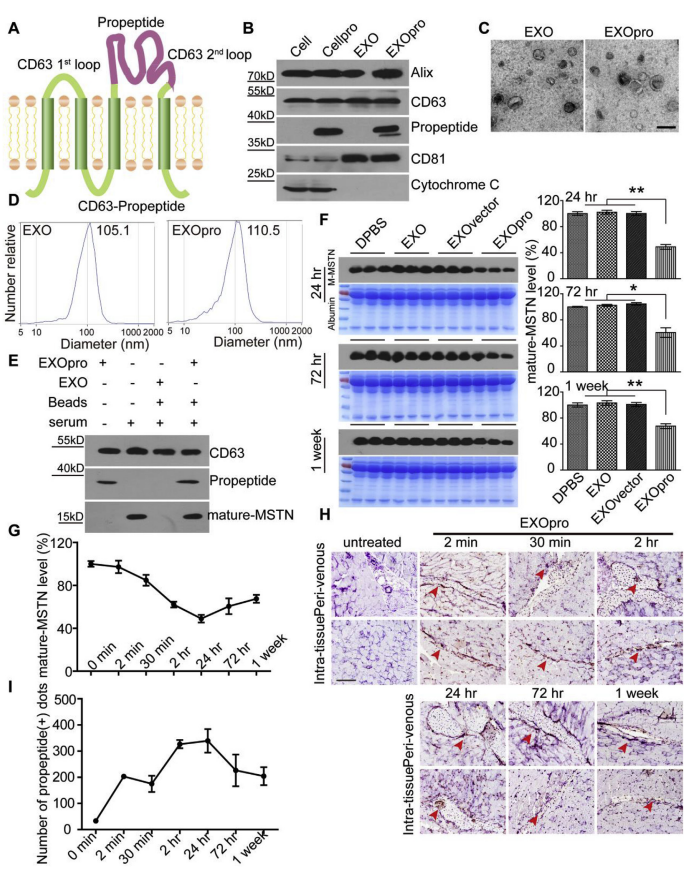
4、靶向改造增强蛋白多肽的递送特异性及效率
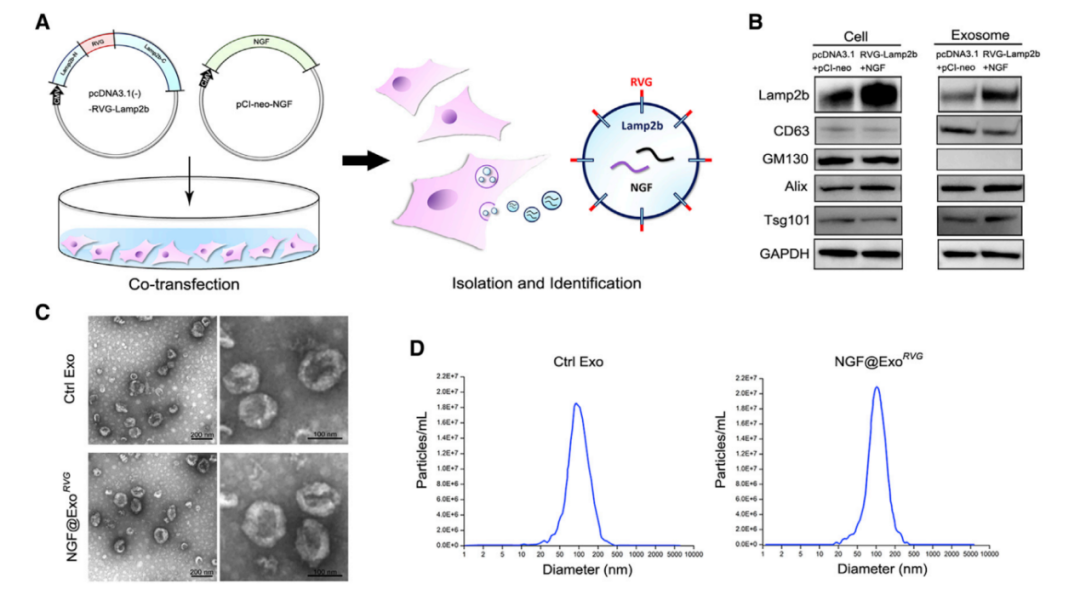
神经生长因子(NGF)在缺血后虽然有神经保护功能,但是没有递送到缺血区域的办法。HEK293细胞为亲本细胞,LAMP2B为支架蛋白在外泌体表面融合表达RVG肽,赋予外泌体靶向脑组织的功能,通过在亲本细胞过表达的方式将NGF mRNA和蛋白质负载到外泌体中(NGF@Exo)。无论NGF是以mRNA还是蛋白质形式负载,都能有效地将NGF递送到缺血性皮层中,并增加局部蛋白水平保护神经细胞。
4 个回答
dxy_kzpdkj40
使用负载肿瘤全抗原的纳米粒可比使用多种混合抗原多肽更准确全面的检测肿瘤抗原特异性T细胞
一、多肽用于检测肿瘤抗原特异性T细胞含量的局限性
目前,为了检测肿瘤抗原特异性T细胞,常用的方法是合成1种或多种已知的肿瘤抗原多肽,然后将这些多肽与T细胞共孵育以刺激激活肿瘤抗原特异性T细胞,随后通过流式细胞术检测IFN-γ等指标来确定肿瘤抗原特异性T细胞的含量。但使用多肽刺激肿瘤抗原特异性T细胞存在种类有限和多样性不足的局限性:用于刺激T细胞的多肽通常是多个抗原多肽的混合物,但是肿瘤抗原成千上万,很难合成所有的抗原多肽。因而所能刺激激活被检测到的肿瘤抗原特异性T细胞种类有限,不全面。所使用的抗原多肽库的多样性不足,限制了使用混合多肽刺激后检测肿瘤抗原特异性T细胞的检测的全面性和准确性。
二、负载肿瘤全细胞抗原的纳米颗粒在肿瘤抗原特异性T细胞检测中的优势
相比之下,负载肿瘤全细胞抗原的纳米颗粒在检测肿瘤抗原特异性T细胞方面展现了显著的优势。该纳米颗粒在使用时,只需与含有T细胞的混合免疫细胞共同孵育就可激活肿瘤抗原特异性T细胞,从而用于后续检测。更重要的是,这些纳米颗粒因其负载肿瘤细胞的全细胞抗原,能够提供全面、多样且广谱的各类肿瘤抗原,从而能够全面、准确检测外周血或者淋巴结等不同组织中的肿瘤抗原特异性T细胞。其优势在于特异性高、检测准确性强,以及所检测的肿瘤抗原特异性T细胞种类更为全面。
最近发表的相关研究表明,使用负载肿瘤全细胞抗原的纳米颗粒与混合免疫细胞共孵育后检测肿瘤抗原特异性T细胞,可以检测到的CD8+ IFN-γ+ 和CD4+ IFN-γ+ 的肿瘤抗原特异性T细胞的含量在10%左右(图b和c)。而使用免疫原性极强的混合抗原多与混合免疫细胞共孵育后,只能检测到少量的CD8+ IFN-γ+ 或CD4+ IFN-γ+ 肿瘤抗原特异性T细胞(图d和e),明显少于使用负载肿瘤全细胞抗原的纳米颗粒刺激后进行检测。这些数据表明,负载肿瘤全细胞抗原的纳米颗粒可以有效刺激激活更多样和广谱的肿瘤抗原特异性T细胞,在肿瘤抗原特异性T细胞检测中具有显著优势。
负载肿瘤全细胞抗原的纳米颗粒为肿瘤抗原特异性T细胞的检测提供了一种更为高效的工具,有望在未来的肿瘤治疗疗效预测和免疫治疗过程监测中发挥更大的作用。
sswei
可通过基因编辑技术使细胞自组装带有外源蛋白/多肽的外泌体,使外泌体成为蛋白多肽类分子非常理想的递送载体。基于外泌体的药物递送,可归结为两种:内源表达和外部装载。内源表达,通过细胞内源表达,使蛋白或 RNA 等药物被分选进入 EVs。这种方式可以降低载药的难度,简单有效地实现药物装载;外部装载,在 EVs 纯化后,通过机械或化学技术暂时打开 EVs 的膜,使化合物扩散到囊泡中。最常见的方法包括超声、电穿孔、皂素处理和孵育等。
loveliufudan
蛋白多肽类药物的递送确实是一个具有挑战性的任务,因为它们在体内递送时受到多种生物学障碍的限制。以下是一些常用的策略和方法,用于改善蛋白多肽类药物的递送:
1. 包裹和保护:使用适当的载体或纳米颗粒来包裹和保护蛋白多肽,以提高它们的稳定性和生物利用度。这些载体可以是脂质体、聚合物纳米颗粒或其他适当的纳米材料。
2. 靶向递送:利用特定的靶向策略将药物直接送达到目标组织或细胞。这可以通过表面修饰或功能化载体,使其能够特异性地与目标组织或细胞相互作用。
3. 载体内部递送系统:使用具有控释功能的载体,例如水凝胶、微球或纳米凝胶,将药物封装在内部,并通过控制释放速率来实现长时间的递送。
4. 载体外部递送系统:结合外部刺激(如磁场、光照或声波)与载体相互作用,以实现准确的递送和释放。
5. 肠道递送增透性增强:针对口服递送,可以使用吸收增透剂、肠黏附剂或纳米颗粒来提高药物在肠道中的吸收和穿透性。
6. 静脉递送辅助技术:对于静脉注射,可以使用辅助技术,如超声辐射、电穿孔或热脉冲,来提高细胞膜通透性以促进药物的进入。
土井挞克树
多肽类主要是包装颗粒要做好,包装颗粒做好了,递送就不难



