Cancer Immunol Res:胃癌免疫治疗新突破!南京大学魏嘉教授团队揭示胃癌免疫微环境全新调控靶点
丁香学术
当前,免疫检查点阻断治疗(ICB, immune checkpoint blockade)作为免疫治疗的主流手段之一,在部分实体肿瘤类型(如黑色素瘤、乳腺癌、肺癌等)已获得重要突破 [1],但 KEYNOTE-059、ATTRACTION-2 等临床研究结果显示 PD-1 抗体在胃癌患者的后线治疗效果欠佳,客观反应率仅为 12% [2, 3]。限制胃癌患者 ICB 疗效的关键原因之一是其肿瘤免疫微环境中的复杂免疫抑制性成分和免疫逃逸机制,因此深入研究胃癌免疫微环境的特异性调控靶点、开发新型干预策略是胃癌免疫治疗所面临的重大难题和迫切需求。
现阶段,针对解除胃癌免疫抑制性微环境的研究以调控肿瘤浸润性 T 细胞及其介导的适应性免疫反应为主;肿瘤相关巨噬细胞(TAM, tumor-associated macrophages)这一免疫细胞亚群在胃癌微环境中的占比更高,认识却相对不足。已有多篇文献揭示了 TAM 对胃癌免疫逃逸的重要作用,其促进免疫抑制的机制包括干扰 T 细胞杀伤功能、影响 DC 抗原提呈效率、招募其他免疫抑制性细胞群体如 Treg、MDSC 等多种途径 [4, 5]。然而目前在研的靶向 TAM 的抗体或小分子抑制剂的 I/II 期临床研究结果并不乐观 [6, 7],且缺乏特异性靶向胃癌微环境中 TAM 的有效干预手段。
2022 年 12 月 2 日,来自南京大学魏嘉教授的研究团队在 Cancer Immunology Research 上发表了题为 DKK1 Promotes Tumor Immune Evasion and Impedes Anti–PD-1 Treatment by Inducing Immunosuppressive Macrophages in Gastric Cancer 的研究,阐明了胃癌微环境全新免疫调控靶点 DKK1 诱导巨噬细胞免疫抑制、促进胃癌进展的新机制,并且提出联合靶向 DKK1 与 PD1 的阻断治疗有潜力成为胃癌免疫治疗的新策略。
https://doi.org/10.1158/2326-6066.CIR-22-0218
首先,研究人员收集了本中心约 300 例胃癌患者肿瘤组织样本,并整合分析了来自 TCGA-STAD、ACRG 等公共数据库的样本,发现胃癌组织的 DKK1 表达量明显高于正常组织,与各种免疫标志物(PDL1、TMB、MSI 等)存在显著相关性,并预示患者较差的预后。以上临床数据提示 DKK1 可能是胃癌患者免疫治疗应答及预后的一种潜在标志物。
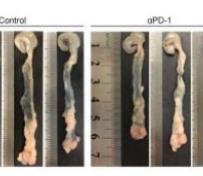
为了探索胃癌 DKK1 表达在体内的影响,研究人员使用了包括小鼠皮下、原位、腹腔转移、免疫缺陷在内的多个胃癌模型,研究阻断 DKK1 能否抑制肿瘤生长。结果显示给予 DKK1 单克隆抗体 mDKN-01 可有效控制多个胃癌模型的肿瘤进展,并展现出较好的生物安全性。此外,研究人员发现,阻断 DKK1 还可显著改善小鼠肿瘤局部的免疫微环境,具体表现为增强 CD8+ T 和 NK 细胞的浸润及杀伤功能,升高巨噬细胞 M1/M2 比例,促进 DC 浸润并提高其抗原提呈能力,提示 DKK1 有潜力成为胃癌免疫治疗新靶点。
为了明确阻断 DKK1 如何介导小鼠胃癌模型的肿瘤控制并改善免疫微环境,研究人员在小鼠胃癌模型中依次清除了 CD8+ T、NK 与 TAM,发现仅有 TAM 的清除可逆转 DKK1 阻断的抗肿瘤效果,因而猜测 TAM 是 DKK1 介导免疫调控的关键环节。体外实验结果发现 DKK1 可结合巨噬细胞表面受体 CKAP4,显著激活下游 PI3K-AKT 信号通路,从而直接刺激巨噬细胞分化为免疫抑制性表型。此外,在体外共培养模型中,经 DKK1 诱导的巨噬细胞可明显降低 CD8+ T 和 NK 细胞所表达的免疫激活标志物与释放的细胞因子水平,抑制两种细胞的肿瘤杀伤功能。而 TAM 免疫抑制功能可被 PI3K 小分子抑制剂有效逆转。研究人员通过体内外多种研究手段揭示了胃癌细胞分泌的 DKK1 是巨噬细胞免疫抑制的重要诱导因素,可进一步损害 CD8+ T 和 NK 细胞的抗肿瘤免疫功能,从而介导胃癌免疫逃逸。
最后,鉴于 TAM 曾被报道为影响胃癌患者 PD-1 单抗疗效的关键因素 [8],研究人员进一步观察了 DKK1 与 PD-1 联合阻断在鼠源和人源化胃癌模型中的效果,发现近 1/3 接受联合治疗的小鼠肿瘤完全消失(CR);联合阻断还能协同改善胃癌免疫微环境。
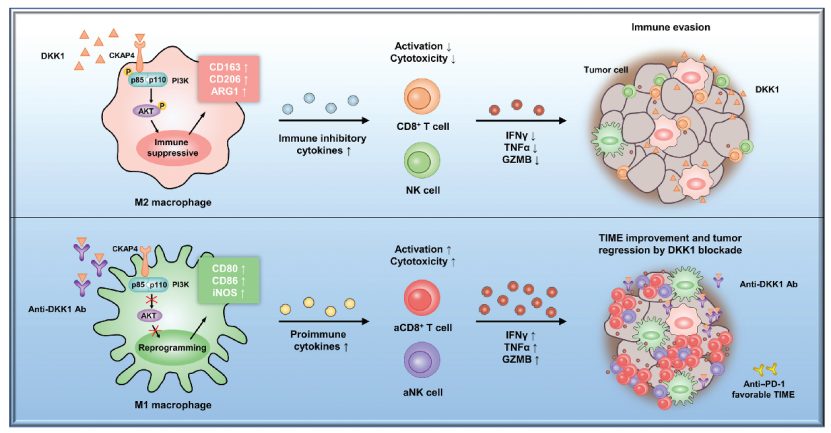
总体而言,该项研究发现胃癌肿瘤组织特征性高表达 DKK1,可介导 TAM 免疫抑制表型,从而抑制杀伤性淋巴细胞的激活和抗肿瘤作用,最终促进胃癌肿瘤进展和免疫逃逸。这一研究结果首次证明了 DKK1 对 TAM 的调控作用,提出了胃癌免疫微环境负性调控的全新机制,并展示了一种极具应用潜力的联合治疗手段,为开发胃癌免疫治疗新策略提供了思路。值得一提的是,该研究直接推进了联合阻断 DKK1 和 PD1 用于进展期胃食管腺癌患者治疗的 I/II 期临床试验(NCT04363801)的开展,目前试验正在进行中,并获得了积极进展。
南京大学医学院施涛博士为本文的第一作者。本研究受到了国家自然科学基金、江苏省杰出青年基金、教育部中央高校基础研究专项基金的资助。