基于多重免疫荧光 (mIF) 技术的空间表型特征用以开发新一代生物标志物
Akoya
越来越多的研究表明,基于多重免疫荧光(mIF)技术的空间表型特征正在用以开发新一代生物标志物,它使用多重抗体面板在完整组织样本中通过所处环境中的功能和状态来描述肿瘤和免疫细胞的特征。不同的细胞密度模式和相互作用构成的细胞间肿瘤微环境中(TME)已被证明可以对疾病结果和免疫治疗反应高度预测。
在《空间表型特征:表征实体肿瘤和预测免疫治疗反应的新型生物标志物》白皮书中介绍了基于 mIF 的空间表型特征作为新一代生物标志物发现的案例,意义和价值。
目前,只有少数经 FDA 批准的生物标志物鉴定的患者对 PD-1/PD-L1 检查点抑制剂治疗表现出阳性反应,而且,并不是所有测试结果呈阴性的人最后都表现很差。这种不确定性使得本可以受益的患者无法得到治疗,增加了治疗无效的癌症护理成本,阻碍了下一代免疫疗法的发展。
基于多重免疫荧光(mIF)的技术的空间表型特征,是新一代病理工作流程,可生成有关癌症样本的定量和可重复的见解,具有预测价值和临床洞见方面的潜在价值,可能在不久的将来进入常规临床实践中的标准工具。
设定新的预测值标准
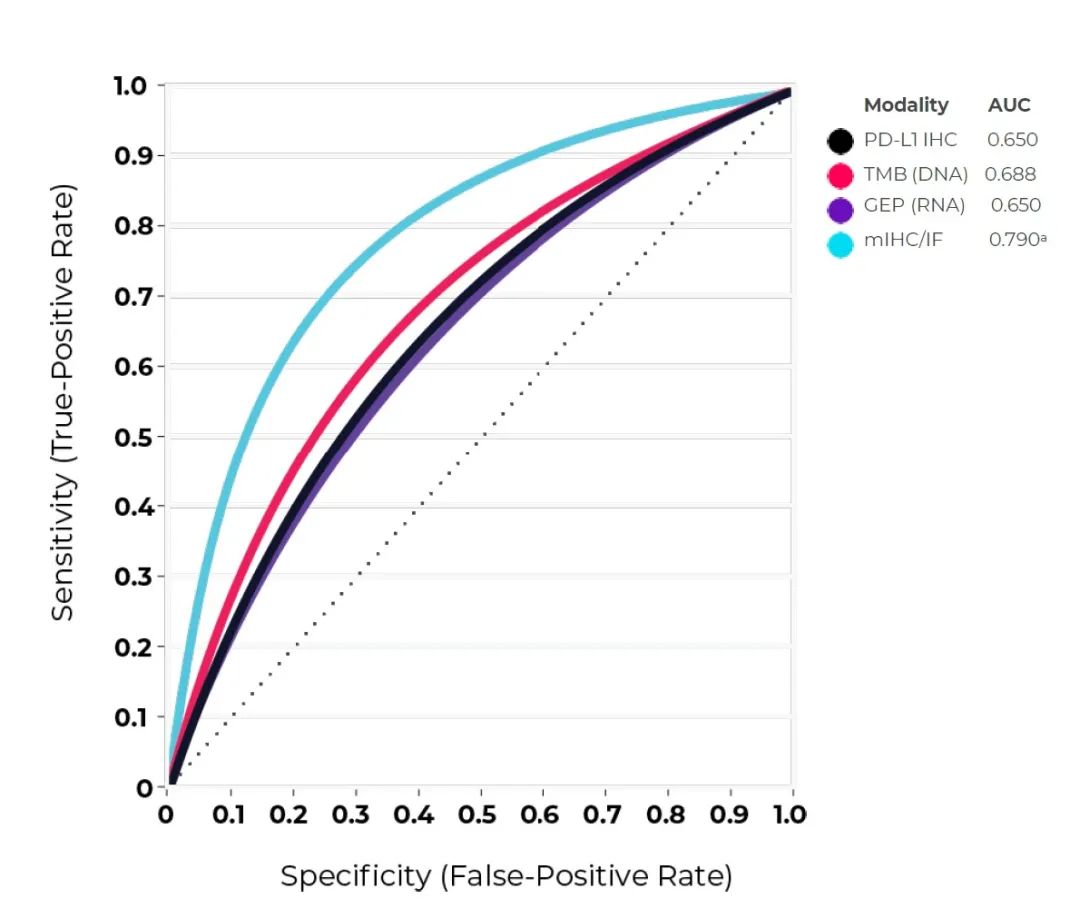
空间表型的核心是一种被称为多重免疫荧光(mIF)的技术,这是新一代病理工作流程,可生成有关癌症样本的定量和可重复的见解。Lu 等人发表在《JAMA Oncology》上的一项多种诊断技术的 meta 分析显示,在预测谁将对 PD-1/PD-L1 免疫治疗产生反应方面,mIF 比目前广泛使用的技术 PD-L1 IHC、基于下一代测序的肿瘤突变负荷(TMB)和基因表达谱(GEP)具有更高的预测价值。
mIF:揭示 PD-1/PD-L1 阻断反应的新见解
多项研究表明,使用基于 mIF 的平台检测 PD-L1 表达,可以获得更量化、更准确的结果,提高预测能力。此外,mIF 允许与其他标记物同时检测 PD-L1 表达,从而产生比单独使用每个标记物更高的预测值。
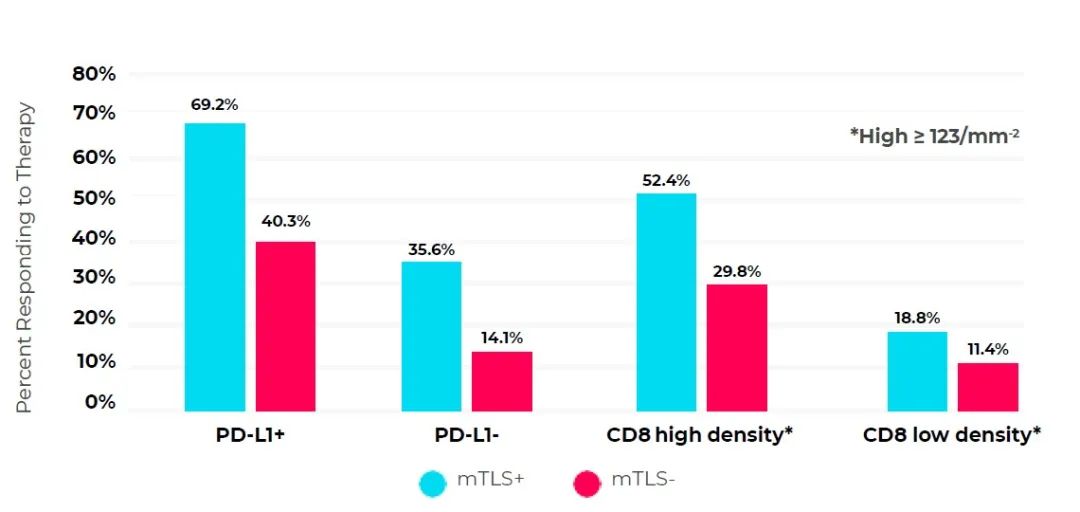
Vanhersecke 等人在一项对 11 种不同肿瘤类型的泛癌研究中证明了这一点,其中 PD-L1 表达分析与三级淋巴结构(TLS)和 CD8+ 淋巴细胞密度的测量配对。使用结合 CD4、CD8、CD20、CD21 和 CD23 的 mIF 分析来识别 TLS,并区分成熟(mTLS)和不成熟(iTLS)形式。这些发现强调了基于 mIF 的多重分析在预测价值和临床洞见方面的潜在价值。
寻找更好的预测工具
到目前为止,FDA 已经批准了 7 种针对 PD-1/PD-L1 通路的肿瘤免疫疗法,其中三种包括对 PD-L1 表达进行 mIHC 染色的辅助诊断,两种需要 DNA 或 RNA 测序来识别微卫星不稳定性、肿瘤突变负担或错配修复错误。
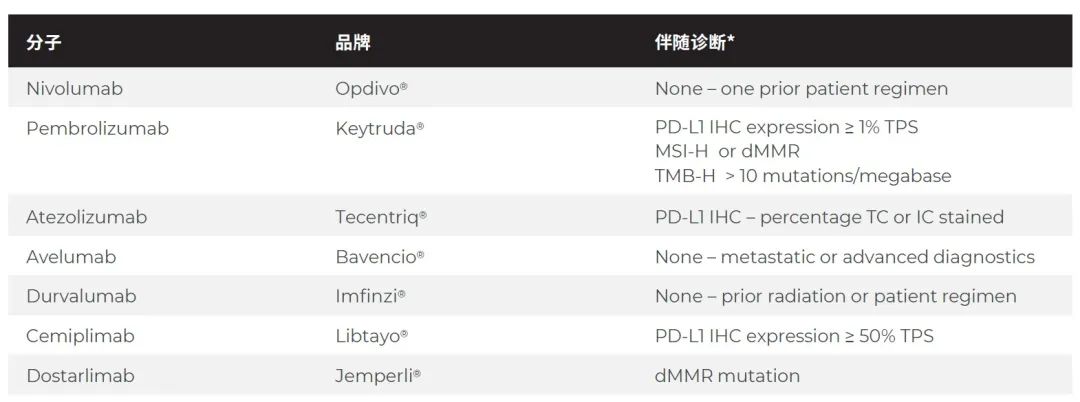
随着抗 PD-L1 疗法的数量增加,不同的检测要求也在增加。如表中所示,使用 PD-L1 IHC 染色有四种不同的评分算法,有些聚焦于 TCs(肿瘤细胞),有些聚焦于 ICs(免疫细胞),所有这些都需要一些主观的操作判断。Rimm 等人注意到,当试图对 ICs 上的 PD-L1 表达进行评分时,病理学家观察者之间的一致性特别差,特别是在低表达范围。所有这些都表明需要新的肿瘤组织分析方法,以减少实验室间和观察者之间的可变因素,并提高每个样本的预测价值。
临床病理学实验室中基于 mIF 方法的空间表型特征
在堪称里程碑的多机构 TSA 扩增多重免疫荧光重复性评估(MITRE)研究中,6 家机构使用了 mIF 解决方案,以证明和验证了一个基于肿瘤组织样本中的 PD-1/PD-L1 免疫检查点信号自动化的端到端工作流程。研究结果表明,在测量 IC 密度、共表达和接近参数方面,实验室内和实验室间的一致性很高。MITRE 的结果代表着基于 mIF 方法的自动化空间生物学工作流程标准化的重要一步,该工作流程提供了支持临床试验所需要的性能水平,并可在未来应用于临床试验。
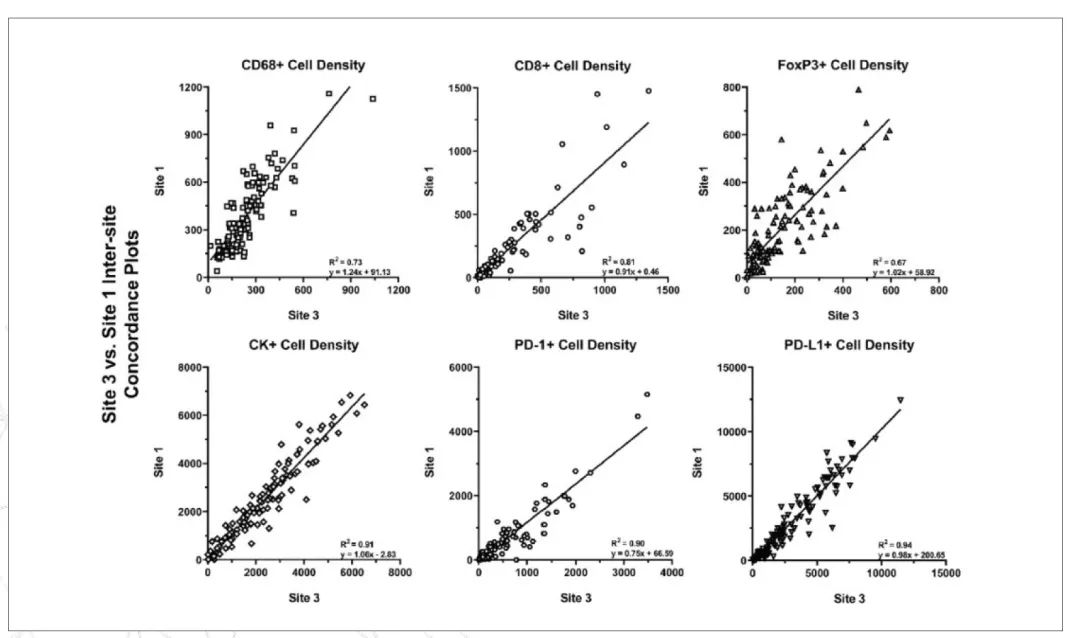
一个由来自来学术界、制药和诊断制造商的病理学家和其他专家组成的癌症免疫治疗协会(SITC)工作组,正在评估 mIF 工具在常规临床检测中的使用情况。该工作组将 mIF 技术称为“可能在不久的将来进入常规临床实践中的标准工具”。他们目前正在建立最佳方案,“以帮助确保实验室间输出结果的稳定性和可比性”。
基于 mIF 的空间表型特征正在开发新一代的生物标志物。像MITRE这样开创性的研究使用了标准的 PhenoImager 解决方案。PhenoImager 解决方案集成了染色、成像和分析,使用现有的工作流程和技能来定量捕获细胞组织的细节,并整合到整个样本中,以获得丰富的洞见,了解疾病的机制和脆弱性。