酵母分批培养实验操作方法
互联网
- 相关专题
- 酵母细胞的培养专题
一、目的
1. 掌握微生物 分批培养的生物反应器操作;
2. 掌握的菌体浓度、总糖等参数测定方法;
3. 掌握分批培养 的生长动力学及生长曲线的测定方法。
4. 了解酵母 的生长特性。
二、原理
分批反应操作是指基质灭菌、接种以后,除了好氧反应需要在反应过程中通入无菌空气、消除泡沫所用的消泡剂以及维持一定pH值所用酸碱之外,反应过程中不再加入反应基质。
基质浓度、产物浓度以及细胞浓度均随反应进行的时间而变化,尤其是菌体本身将经历不同的生长阶段(在培养的过程中,微生物的生长可分为迟缓期、对数生长期、减速期、静止期),显示出不同的催化活力。
基本特征是:反应物料一次加入一次卸出;反应器物系的组成仅随时间而变化,即随着培养的进行,基质的浓度下降,菌体量增加,产物增加。因此它属于一非稳态过程。
三、主要试剂与设备
酵母、培养基、菲林试剂、0.05N NaOH 1mg/ml葡萄糖标准溶液等
100L机械搅拌式反应器、pH计、离心机、分光光度计等
四、步骤
(一)准备工作
1. 发酵罐的组装工作
(1) 连接好冷却水管。若采用自来水冷却,要考虑到白天与夜间水压的变化,尽可能采用耐压管,连接部要充分牢固,并且注意连接管管径与自来水管管径应一致。
(2)由于通人的空气有一定压力,应注意连接压缩空气的管子应能承受一定压力。
(3)安装pH及溶解氧等检测装置,注意各接线口不要出现差错。由于操作过程要和水打交道,故线路连接一定要注意安全,要特别注意防止漏电。
2. 种子培养
(1) 液体试管培养:自斜面菌种挑取一环酵母菌体,接入装有10ml 10-12ºBx无菌麦芽汁的液体试管中。摇匀,置于30℃培养箱24h.
(2) 三角瓶装培养:将上述培养好的液体试管种子接入250m1三角瓶的灭过菌的100 10-12ºBx的麦芽汁,接种量10%, 30℃培养箱15-20h.
3. 培养基的配置:按配方配置发酵罐。培养基的体积通常为罐容积的50-60%。准确称量培养基各组分,溶解。一般配置培养基的体积为预定的70%,因为灭菌时,通入的蒸汽发生冷凝,会使发酵液的体积增加。使用合成培养基时,将糖类及磷酸盐溶液分别用高压灭菌锅灭菌,开始培养前放入发酵罐内,这是为了避免灭菌时糖类物质与氨基化合物反应生成褐色物质,以及防止磷酸盐与其它金属离子生成沉淀。
4. 发酵装置(罐)的清洗
发酵罐使用前后都应认真清洗,特别是前后两次培养采用不同的菌株时,更应注意清洗和杀菌工作。
发酵罐有多种型式,罐内(可进行清洗的)任何部分都应认真清洗,否则都可能成为杂菌的滋生地。一般认为,发酵前期引起杂染菌的主要原因是由于清洗不净。易被忽略而未能充分清洗的地方有喷嘴内部与取样管内以及罐顶等处。另外,还应充分注意发酵罐周围的附件设备,如加热器、电机等的安全使用。
5. 电极的标定
对pH电极和溶氧电极进行零点校正和斜率校正。
6. 参数的控制及设定
根据发酵要求在操作面板或反应器应用程序上进行设定。
发酵控制参数值如下:
温度30℃ 时间48h, 空气流量 —— 转速 80-100r/min
(三)发酵罐发酵
步骤如下:
清洗→空消→实消→冷却→接种→发酵→取样→放罐
1. 蒸汽的产生
(1) 打开蒸汽发生器进水阀和放气阀,加水至水位上限,关闭进水阀和放气阀。
(2) 启动蒸汽发生器电源开关加热至0.40MPa左右。
2. 空消
空气过滤系统只空消,不实消,以免实消罐中物料冲入过滤器内;
(1) 通蒸汽前检反应器所有阀门是否关闭。
(2) 打开蒸汽发生器排冷凝水的阀门,排放冷凝水至蒸汽出现,关闭此阀门;然后打开蒸汽发生器供给反应器蒸汽的阀门。
(3) 进蒸汽顺着蒸汽管路开阀门,蒸汽为活汽。打开罐顶排气,先对空气过滤系统灭菌,顺着气路开阀,再开尾阀排冷凝水,排掉冷空气,待有蒸汽冲出后调小,打开主阀,保证有活蒸汽放出,但不能太大,以免分压;再进罐体,蒸汽分三路进罐,先主管道,后次管道;蒸汽也按以上规则顺行进路径开阀,先开支路阀,再开排汽阀,最后为进罐阀。
(4) 罐压升至0.12MPa(此时控制系统中温度读数约为120℃左右)时开始计时,灭菌30min。灭菌时,保持各阀排气通畅,防止存在死角。保压方式:a. 调节主汽路进汽阀门控制进汽量;b. 调节空气排气口阀门大小或出汽阀大小。
(5) 灭菌结束时,逆着进路关阀门。空气过滤系统先关主阀后关尾阀,完成;进罐蒸汽管路先关进汽阀,再排汽阀,最后为支路阀。但空消一结束,即要通入无菌空气吹干空气过滤系统管路并保压,避免染菌。
(6) 打开罐顶排汽阀直至表压为零,再通过罐底排空罐里的冷凝水。
注:粗过滤器不空消也不实消,要定期处理,所以必须关闭通向粗过滤器的阀门。
3. 实消
(1) 将pH电极和溶氧电极装上,悬紧螺旋。
(2) 打开进料口进料。
(3) 进料完成后,向夹套中通入蒸汽将发酵液加热至80℃以上,关闭蒸汽阀门。随后向发酵液通入蒸汽至0.12MPa,保持30min。灭菌时,保持排气通畅,使罐内空气充分排出,同时使出口管内灭菌更充分。如果不预先加热夹套,会生成大量的冷凝水,导致发酵罐内发酵的培养基的体积很难控制。
4. 冷却:
灭菌结束后,立即打开冷却水(下进上出)至30℃。
5. 接种、发酵:
适当降低通风量,使高压接近零。在接种口(进料口)周围放置浸有酒精的棉花,点燃后迅速打开接种口,将菌种加入到发酵罐中,旋紧接种口盖子,熄灭火焰,调节通风量,接上玻璃转子流量计,使流量计读数在8.0左右,同时保持罐压0.04Mpa,保温保压发酵48hr
6. 取样
培养基放入罐前取50ml,测定其还原糖,菌体量。发酵每隔4h后取样100 m测定菌体量、总还原糖。取样时,将取样口最初的10ml培养液弃掉。
具体操作如下:
(1) 须提前半小时,开启蒸汽发生器,送入蒸汽,开启阀门1,2,蒸汽灭菌。
(2) 半小时后,关阀门1,立即开启阀门3,先放弃部分培养液,再取样100ml左右至灭菌三角瓶中(标注好取样日期、时间、取样人),冷藏备测。
(3) 关闭阀门3,开启阀门1,半小时后关闭阀门2,再关阀门1。
7. 放罐:
培养完成时,除取出足够量的培养液作为样品外,剩余培养液要经过杀菌处理。此时发酵罐所装有的电极可一同经杀菌处理。如果培养液为无害物质,可将电极单独取出处理,以利于延长电极使用寿命。
杀菌完成后,温度降低到一定温度时,取出电极,将杀菌后培养液丢弃到指定地点。一般培养液温度较高时,有难闻气味产生,因此,排放温度应尽可能低一些。
8. 清洗:
空罐后,加大排气,使表压掉零,取出各探头,加盖,由进料口加入净水关好,罐内升压,放罐,如此重复两次。清洗、空消、实消、冷却操作完全一致;
五、记录、数据处理
(一) 测定方法:
1. 菌体浓度测定:
将培养液适当稀释后,在660nm,波长下测其浊度,同时采用血球记数。
2. 还原糖测定方法:
采用菲林法测定。
(二) 记录:
数据采集:系统自动采集,每2min采集一组数据并存贮,包括:温度、溶氧、pH、等,系统可自动给出有关曲线。同时由值班者每30min记录一次,准确填表,获取数据制作过程曲线。
值班人员做好记录,发酵罐每隔4h取样。按表1 记录。
表1 酵母发酵批报
罐批 1 接种时间 14:26 放罐时间
| 取样时间 | 14:44 | 19:20 | 22:30 | 01:20 | 04:20 | 07:20 | 15:24 |
| 培养时间/h | 0.30 | 4.90 | 8.07 | 10.90 | 13.90 | 16.90 | 24.97 |
| pH | 6.07 | 5.93 | 5.4 | 4.93 | 4.47 | 4.49 | 4.11 |
| 罐温℃ | 33.90 | 30.20 | 31.10 | 31.10 | 31.70 | 32.00 | 32.40 |
| OD | 0.943 | 0.883 | 1.250 | 1.360 | 1.516 | 1.514 | 1.880 |
| 菌体浓度/(个/1.00E-4mL) | 710 | 555 | 1070 | 1290 | 1780 | 5078 | 5250 |
| 还原糖/(mg/100mL) | 2688 | 2444 | 2067 | 1920 | 1680 | 1519 | 840 |
| 取样时间 | 18:24 | 21:28 | 00:28 | 03:28 | 06:28 | 09:28 | 11:18 |
| 培养时间/h | 27.97 | 31.03 | 34.03 | 37.03 | 40.03 | 43.03 | 44.87 |
| pH | 3.95 | 3.91 | 3.81 | 3.75 | 3.88 | 3.85 | 3.84 |
| 罐温℃ | 31.50 | 30.20 | 31.70 | 32.00 | 31.80 | 32.00 | |
| OD | 1.992 | 1.927 | 4.832 | 4.572 | 3.916 | 4.468 | 4.468 |
| 菌体浓度/(个/1.00E-4mL) | 5550 | 5300 | 4720 | 2940 | 1040 | 3400 | 5380 |
| 还原糖/(mg/100mL) | 672 | 430 | 272 | 213 | 79.5 | 52.5 | 44.6 |
(三)以时间为横坐标,菌体浓度、 还原糖%、pH、OD为纵坐标作图,观察各参数的变化。采用计算机拟和对数生长期的动力学方程。
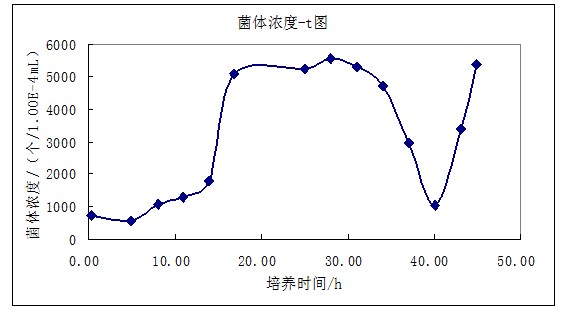
图1 菌体浓度-t图
<center> <img alt="酵母分批培养实验操作方法" height="313" src="http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378380649.jpg" width="562" /></center>图2 还原糖-t图
<center> <img alt="酵母分批培养实验操作方法" height="319" src="http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378380644.jpg" width="557" /></center>图3 pH-t图
<center> <img alt="酵母分批培养实验操作方法" height="286" src="http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378380647.jpg" width="558" /></center>图4 OD-t图
<center> <img alt="酵母分批培养实验操作方法" height="297" src="http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378380643.jpg" width="554" /></center>由图1可看出,22:30-07:20为对数生长期
表2 对数生长期部分数据表
| 取样时间 | 19:20 | 22:30 | 01:20 | 04:20 | 07:20 |
| 培养时间/h | 4.90 | 8.07 | 10.90 | 13.90 | 16.90 |
| OD | 0.883 | 1.250 | 1.360 | 1.516 | 1.514 |
| 菌体浓度/(个/1.00E-4mL) | 555 | 1070 | 1290 | 1780 | 5078 |
| 还原糖/(mg/100mL) | 2444 | 2067 | 1920 | 1680 | 1519 |
| pH | 5.93 | 5.4 | 4.93 | 4.47 | 4.49 |
| t-t' | 0 | 3.17 | 6.00 | 9.00 | 12.00 |
| In(X/X') | 0 | 0.656 | 0.843 | 1.165 | 2.214 |
注:t为培养时间/h,X为菌体量/(个/1.00E-4mL)。t’X’为19:20时对应的培养时间和菌体浓度,t’=4.90,X’=555(个/1.00E-4mL)
图5 以菌体数量拟合对数生长期动力学方程
<center> <img alt="酵母分批培养实验操作方法" height="277" src="http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378380648.jpg" width="563" /></center>所以,对数生长期动力学方程:dX/dt=0.1701X
(四)用图示表示比生长速率[μ=(dX/ dt) /X随时间变化趋势。
| 培养时间/h | 0.30 | 4.90 | 8.07 | 10.90 | 13.90 | 16.90 | 24.97 |
| 菌体量/(1.00E-4mL) | 710 | 555 | 1070 | 1290 | 1780 | 5078 | 5250 |
| μ | -0.0535 | 0.207 | 0.0661 | 0.107 | 0.349 | 0.00413 | |
| 培养时间/h | 27.97 | 31.03 | 34.03 | 37.03 | 40.03 | 43.03 | 44.87 |
| 菌体量/(1.00E-4mL) | 5550 | 5300 | 4720 | 2940 | 1040 | 3400 | 5380 |
| μ | 0.0185 | -0.0151 | -0.0386 | -0.158 | -0.346 | 0.395 | 0.249 |
t为取样时的培养时间,t’为前一次取样时的培养时间
X为取样时的菌体浓度,X’为前一次取样时的菌体浓度
μ=In(X/X’)/(t-t’) μ为t-t’时代平均比生长速率
图6 比生长速率图
<center> <img alt="酵母分批培养实验操作方法" height="290" src="http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378380646.jpg" width="557" /></center>六、思考题:
1. 空消时,应注意什么?
(1)空消时,一定要排尽发酵罐夹套内的余水。否则可能会导致发酵罐内筒体压扁,造成设备损坏。
(2)设备初次使用或长期不用后启动时,最好采用间歇空消,以便消除芽孢。
(3)空气过滤系统只空消,不实消,以免实消罐中物料冲入过滤器内;粗过滤器不空消也不实消。
(4)除菌过滤器的滤芯不能承受高温高压,因此,蒸汽减压阀必须调整在0.13Mpa,不能超过0.15Mpa(关于两个压力值,从不同的地方查到的数据相互间有出入,具体可根据设备而异)。
(5)空消时开尾阀排冷凝水,排掉冷空气,保证有活蒸汽放出,但不能太大,以免分压。
(6)空消时,溶氧电极,pH电极取出,可以延长使用寿命。
(7)空消一结束,即要通入无菌空气吹干空气过滤系统管路并保压,避免染菌。
2. 微生物接种一般接种方法有几种?
(1)火焰接种法:在接种口用酒精火圈消毒,然后打开接种口盖,迅速将接种液倒入罐内,在把盖拧紧。
(2)差压法:在灭菌前放入垫片,接种时把接种口盖打开,先倒入一定量的酒精消毒。待片刻后把种液瓶的针头插入接种口的垫片。利用罐内压力和种液瓶内的压力差,将种液引入罐内,拧紧盖子。
3. 配置培养基应注意什么?
(1)一般配置培养基的体积为预定的70%,因为灭菌时,通入的蒸汽发生冷凝,会使发酵液的体积增加。
(2)使用合成培养基时,将糖类及磷酸盐溶液分别用高压灭菌锅灭菌,开始培养前放入发酵罐内,这是为了避免灭菌时糖类物质与氨基化合物反应生成褐色物质,以及防止磷酸盐与其它金属离子生成沉淀。
七、分析讨论:
1.关于OD值与菌体量变化的分析比较
表3 OD值与菌体量变化比较表
| 取样时间 | 14:44 | 19:20 | 22:30 | 01:20 | 04:20 | 07:20 | 15:24 |
| OD | 0.943 | 0.883 | 1.250 | 1.360 | 1.516 | 1.514 | 1.880 |
| 菌体浓度/(个/1.00E-7mL) | 0.710 | 0.555 | 1.070 | 1.290 | 1.780 | 5.078 | 5.250 |
| 对应图6中编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 取样时间 | 18:24 | 21:28 | 00:28 | 03:28 | 06:28 | 09:28 | 11:18 |
| OD | 1.992 | 1.927 | 4.832 | 4.572 | 3.916 | 4.468 | 4.468 |
| 菌体浓度/(个/1.00E-7mL) | 5.550 | 5.300 | 4.720 | 2.940 | 1.040 | 3.400 | 5.380 |
| 对应图6中编号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
图7 OD值与菌体量变化比较图 图中虚线为菌体浓度变化,实线为OD值变化
<center> <img alt="酵母分批培养实验操作方法" height="286" src="http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378380645.jpg" width="561" /></center>由图可看出,在第6至9个点(即07:20-21:28)段OD值与菌体浓度变化趋势相差较大。可能原因是:菌体浓度在5-6间(04:20-07:20)迅速积累,细胞的增殖速度超过细胞物质的合成速度,导致分裂后的菌体体积减小,相同菌体浓度的吸光度下降,所以OD值并不立即随菌浓度量上升而上升。直到9-10段(21:28-00:28)菌体合成大量细胞物质使吸光度上升。但OD值相对菌体浓度变化的滞后一般不会太长,而本次实验中则滞后了约17h。这可能是因为在08:10-14:24间断电,停止通氧导致菌体代谢减慢,在从新开始供氧后菌体又需要一段时间适应环境变化,恢复代谢,从而导致OD值对菌体浓度滞后时间长。另外,在缺氧时,可能会出现某些代谢产物积累,影响之后的菌体代谢,这也会延长OD值对菌体浓度的滞后时间。
在第10至14个点(即00:28-11:18)段OD值变化趋势与菌体浓度相同,但变化程度菌体浓度远大于OD值。可能原因是:菌体裂解后的细胞碎片的干扰导致测得的OD值偏大。
2.菌体浓度在06:28-11:18时间段上升到原因
实验使用的培养基中除葡萄糖外还还有大量其它糖类,当葡萄糖被消耗完后菌体大量死亡,但也有部分菌合成利用其它糖类的诱导酶,出现二次生长,使菌体浓度上升。
二次生长时由于营养成分不如第一次大量生长时丰富,有害代谢产物浓度也比较高,因此所能达到的最菌体浓度往往比第一次低。而本次实验中,二次生长达到的最高菌体浓度与第一次相当。出现这种情况的原因有两个:第一,由于显微镜出现问题,最后几次的菌体浓度未能及时测定,产生误差。第二,在第一次生长的对数期末停电,供氧中断。因此,实际的对数生长期持续时间可能更长,菌体浓度能达到更高值,但由于缺氧抑制了菌体的繁殖,最终菌体浓度只达到了这个较低的值。
3.菌体浓度和OD值哪个更适合作为选取对数生长期的标准
对数生长期的选取应以活菌数为标准,但本次实验所测的数据没有一个可以直接反映活菌数,只有菌体浓度和OD可以间接反映。这两个参数都不能消除死细胞的影响,但OD还同时受菌体大小和裂解后的细胞碎片影响,因此准确性比菌体浓度低。所以,菌体浓度更适合作为选取对数生长期的标准。
附1:
直接滴定法
一、 实验原理
样品加入盐酸后,糖类水解转化糖,再经除去蛋白质,在加热条件下,直接滴定标定过的碱性酒石酸铜液,以次甲基蓝作指示剂,根据样品液消耗体积,计算还原糖量。
二、 试剂与设备
1、 碱性酒石酸铜甲液:称取15g硫酸铜及0.05g次甲基蓝,溶于水中并稀释至1000ml。
2、 碱性酒石酸铜乙液:称取50g酒石酸钾钠及75g氢氧化钠,溶于水中,再加入4g亚铁氰化钾,完全溶解后,用水稀释至1000ml,贮存于橡胶塞玻璃瓶内。
3、 乙酸锌溶液:称取21.9g乙酸锌,加3ml冰乙酸,加水溶解并稀释至100ml。
4、 10.6%亚铁氰化钾溶液。
5、 盐酸、6mol/L盐酸、20%氢氧化钠
6、 葡萄糖标准溶液:精密称取1.000g经过98~100℃干燥至恒量的纯葡萄糖,加水溶解后加入5ml盐酸,并以水稀释至1000ml。此溶液每毫升相当于1mg葡萄糖。
三、 实验步骤
1、 取100ml样品置于200ml容量瓶中,加入50ml水,摇匀后再加入6NHCl 10ml,在68~70℃水浴中加热30min,冷却后加入两滴甲基红指示剂,用20%NaOH中和至中性,再加入5ml乙酸锌以及5ml10.6%亚铁氰化钾溶液,加水至刻度,混匀,静置30min,用三层纱布过滤,弃去初滤液,滤液备用。
2、 标定碱性酒石酸铜溶液:吸取5.0ml碱性酒石酸铜甲液及5.0ml乙液,置于150ml锥形瓶中,加水10ml,加入玻璃珠两粒,从滴定管加约9ml葡萄糖标准溶液,控制在2min内加热沸腾,趁沸腾以每两秒一滴的速度继续滴加葡萄糖标准溶液,直至溶液蓝色刚好褪去为终点,记录消耗葡萄糖标准溶液的总体积,同时平行操作三份,取其平均值,计算每10ml (甲、乙液各5ml) 碱性酒石酸铜溶液相当于葡萄糖的质量(mg)。
3、 样品溶液预测:吸取5.0ml碱性酒石酸铜甲液及5.0ml乙液,置于150ml锥形瓶中,加水10ml,加入玻璃珠两粒,控制在2min内加热至沸,趁沸以先快后慢的速度,从滴定管中滴加样品溶液,并保持溶液沸腾状态,待溶液颜色变浅时,以每两秒一滴的速度滴定,直至溶液蓝色刚好褪去为终点,记录样液消耗体积。
4、 样品溶液测定:吸取5.0ml碱性酒石酸甲液及5.0ml乙液,置于150ml锥形瓶中,加水10ml,加入玻璃珠两粒,从滴定管加比预测体积少1ml的样品溶液,使在2min内加热至沸,趁沸继续以每两秒一滴,直到蓝色刚好褪去终点,记录样液消耗体积,同法平行操作三分,得出平均消耗体积。
四、 计算
X(以葡萄糖计)=(m/V~undefined200(mg/100ml)
式中X——100ml样品中所含的总糖的mg ;
m—每10ml碱性酒石酸铜溶液相当于葡萄糖的质量(mg)。
V—消耗碱性酒石酸铜溶液的体积ml
附2
菌体含量测定
浊度法:
血球记数法:
1. 血球计数器 2个
2. 显微镜 2个
3. 空瓶(灭菌)250ml 20个
4. 空瓶 250ml 20个
5. 酸(或碱)式滴定管 2个
6. 电炉 2个
7. 水浴锅 1个
8. 移液管 5ml 4个
9. 漏斗 2个
10. 纱布 若干
11. 定性滤纸 一盒
12. 分光光度计 一台
13. 容量瓶 100或200ml 10个
14. 干燥箱 一台
15. 吸纸 若干
16. 记号笔 2支
17. 标签 若干
18. 洗瓶 4个
19. 烧杯200ml 6个
20. 量筒10ml 4个
21. 玻璃珠 若干
1、 碱性酒石酸铜甲液 2000ml (包含次甲基蓝)
2、 碱性酒石酸铜乙液 2000ml贮存于橡胶塞玻璃瓶内
3、 乙酸锌溶液 200ml
4、 10.6%亚铁氰化钾溶液 200ml
5、 6mol/L盐酸 200ml
6、 20%氢氧化钠 200ml
7、 1mg/ml葡萄糖标准溶液: 1000ml。此溶液每毫升相当于1葡萄糖。
8、 甲基红指示剂 1瓶
9、 菌种:酵母