蛋白表达纯化流程的确认和展望
互联网
1047
蛋白表达纯化流程的确认和展望
为了检验表达
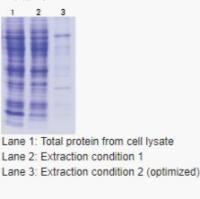
系统和纯化流程的鲁棒性,研究人员选择了一个嗜热微生物――海栖热袍菌的完全蛋白质组,该微生物有1877个ORF,其中46%没有赋予功能注释(Nelson等,1999)。在1877个目标中,有1376个(73%)表达克隆可以通过发酵和纯化过程导出来。这些克隆中的542个(约40%)能够产生微克级的可溶表达的蛋白质,并用于结构测定试验(Lesley等,2002)。可溶的表达蛋白质在海栖热袍菌基因组不同的功能类中的分布表明,蛋白质表达原则途径捕获了一类蛋白质中的至多50%。对于细胞包膜蛋白、转运蛋白及结合蛋白等这些包括大量的膜蛋白或与膜关联蛋白的范畴,这一数字更是明显的低。一般来说,对于蛋白质组规模的蛋白质表达来讲,基因到蛋白质的每一步的消耗都是很可观的。最严重的问题是表达的蛋白质没有可溶性。这完全可以归咎于当前极为有限的在蛋白质折叠时需要特定的结合伴侣或辅助因子方面的知识。目前在基因组水平系统识别多蛋白质复合物已经成为可能,并已经阐明了酵母的基因组(Gavin等,2002)。另外,膜相关蛋白与内在膜蛋白好像不太适合编者选择的表达和纯化策略。
可溶性表达蛋白的功能注释
┌────────────┬─────────────┬──────┬───────┐
│ 蛋白质分类 │ 海栖热袍菌(T.maritirna)│ 可溶性表达│可溶性表达蛋白│
│ │ 蛋白质/个 │ 蛋白/个│所占的比例/%│
├────────────┼─────────────┼──────┼───────┤
│氨基酸的生物合成 │ 72 │ 34 │ 47 │
│辅助因子和辅基的生物合成│ 3l │ 14 │ 45 │
│细胞包膜 │ 73 │ 15 │ 2l │
│细胞周期过程调控蛋白质 │ 49 │ 14 │ 28 │
│主要的中间新陈代谢 │ 44 │ 23 │ 52 │
│DNA代谢 │ 54 │ 15 │ 28 │
│能量代谢 │ 195 │ 88 │ 45 │
│脂肪酸和磷脂代谢 │ 15 │ 6 │ 40 │
│假定蛋白 │ 774 │ 188 │ 24 │
│其他功能蛋白 │ 13 │ 4 │ 3l │
│蛋白质命 (protein fate)│ 48 │ 6 │ 13 │
│蛋白质合成 │ 106 │ 31 │ 29 │
│嘌呤、嘧啶、核苷、核苷酸│ 45 │ 20 │ 44 │
│调控功能蛋白 │ 70 │ 18 │ 26 │
│转录蛋白 │ 16 │ 8 │ 50 │
│转运和结合蛋白 │ 188 │ 30 │ 16 │
│未知功能蛋白 │ 83 │ 28 │ 34 │
│总计 │ 1876 │ 542 │ 29 │
└────────────┴─────────────┴──────┴───────┘
然而,在l天内有效表达和纯化将近100个蛋白质可使研究者有可能解决“消耗”问题。这个问题的解决可以通过产生和试验空前数量的用于表达阳性克隆的不同的基因构造来实现,包括使用不同的亲和标签、改变基因构造的边界和大小、在含多结构域的蛋白质中表达一个稳定的结构域。一旦找到蛋白质的结合伴侣,就可以将这些蛋白质共同表达,与它们的作用伙伴共同纯化。很多不同物种的直系同源蛋白质可以被同时检验,而且表现最佳的蛋白质可以应用于更进一步的研究(Savchenko等,8003)。类似地,通过导人随机突变和定向单点突变的蛋白质工程可以用于改善蛋白质的性质(如稳定性和溶解性)。