【共享】绝对好文:新型蛋白标签概述 『连载』
丁香园论坛
2981
蛋白标签(protein tag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。随着技术的不断发展,研究人员相继开发出了具有各种不同功能的蛋白标签。
一、 新型蛋白标签
蛋白标签应用极为广泛,但仍有两个问题不容忽视:(1)蛋白标签以DNA形式编码,它需要转录并翻译成蛋白后才能发挥作用,而这种作用方式本身就是一种缺陷。例如,常用的荧光蛋白标签,在显微镜下观察时,其显像不如人工合成的荧光基团好,但是这种人工合成的荧光基团却无法通过遗传学操作与目的蛋白进行融合表达;(2)每一种标签一般只适用于一种用途,蛋白的纯化、检测、定位等往往需要不同的蛋白标签。对此问题有一种解决办法,那就是开发一种标签,使其再与各种人工合成的“二级标签”结合,例如荧光基团或亲和基团等等,以实现多种不同的应用。
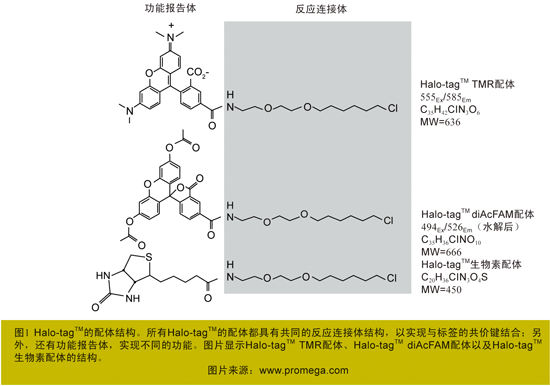
现在已经出现了多种新型蛋白标签,它们都可以与一系列人工合成的配体形成共价键。这些配体包含两种关键结构:(1)反应连接体,即一个蛋白标签反应连接部位,其作用是启动与蛋白标签的共价键的形成;(2)功能报告体,即一个功能报告基团,如荧光染料或亲和反应基团等,通过不同的功能报告基团这种“二级标签”形式,以实现不同的功能(图1)。
随着这类新型蛋白标签及其相应配体的出现,研究人员可选择具有不同荧光的配体对胞内蛋白进行特异性标记。因此,活细胞内的世界逐渐变得更为清晰和丰富多彩;而且与其它标签技术同时使用,可以同时对两个或两个以上的不同蛋白进行标记,从而实现可视化监测。此外,新型蛋白标签的出现,还有助于人们鉴别某一活细胞内的新老蛋白。
接下来,本专题主要介绍几种常用的新型蛋白标签:SNAP-tagTM、CLIP-tagTM、ACP-tagTM、MCP-tagTM以及Halo-tagTM。
1. SNAP-tagTM――一种新型的自我标记标签蛋白
1.1 SNAP-tagTM简介
O6-鸟嘌呤烷基-DNA烷基转移酶(O6-alkylguanine-DNA alky¬ltransferase, AGT)是一种核蛋白,它通过把烷基化DNA链上鸟嘌呤O6-位的烷基转移至自身活性中心的半胱氨酸上,来行使DNA修复功能。严格来讲,AGT不算是一种酶,因为在生理条件下,转移反应只能进行一次,且不可逆。洛桑理工学院(Ecole Polytechnique Fédérale de Lausanne)Kai Johnsson博士科研小组发现,AGT可以特异性并快速地与苯甲基鸟嘌呤(benzylguanine, BG)衍生物发生反应,以共价键结合。随后,通过对AGT进行突变改造,研究人员获得了一种不与DNA链上的鸟嘌呤进行反应的蛋白,该蛋白不再定位于细胞核中,但与小分子BG衍生物的亲和力却大大地提高,而且只有22KDa大小。现在,研究人员赋予了它一个广为人们接受的名字——SNAP-tagTM。
1.1.1 SNAP-tagTM的优点
SNAP-tagTM无论在体内还是体外都可以特异性并快速与其配体,即BG衍生物发生特异性反应,以共价键结合。由于BG可带各种不同的其它化学基团,如生物素、荧光素(fluorescein)、若丹明(rhodamine)等,从而实现一种标签蛋白可以被多种配体标记,是一种具有**性意义的自我标记蛋白标签。

SNAP-tagTM大小为22kDa,在很多常见表达系统中都能够良好表达。目前为止,已有相当数量和种类的蛋白质作为N末端和C末端SNAP-tag融合蛋白被成功表达出来。SNAP-tagTM在蛋白质标记中具有三大优势(表1),可以广泛应用于蛋白标签的各个应用领域,是一种非常理想的蛋白标签。此外,反应的基本原理决定了SNAP-tagTM具有三大优点(表2)。
1.1.2 SNAP-tagTM功能
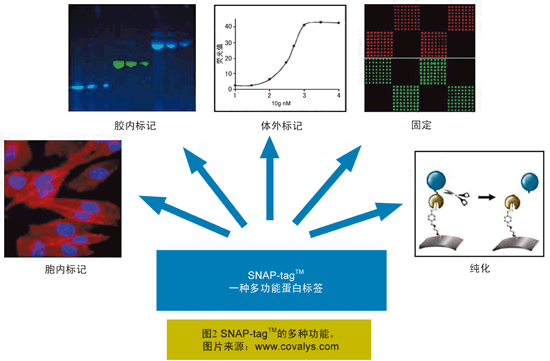
SNAP-tagTM功能多样,可以应用于各种不同的研究,主要包括:可在活细胞或细胞提取物中快速标记融合蛋白;可将蛋白质共价固定于固相介质表面,而无需进行之前的纯化工作;可与蛋白酶配合,在把融合蛋白固定化后,纯化目的蛋白,捕获蛋白复合物;可直接在SDS-PAGE胶中检测SNAP-tagTM融合蛋白(图2)。
1.2 SNAP-tagTM技术原理
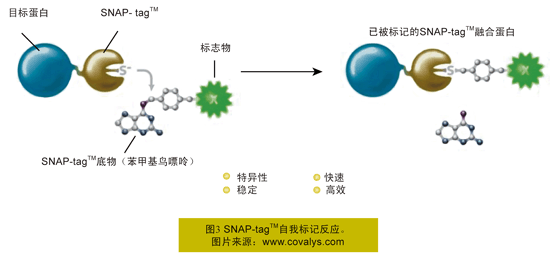
1.2.1 SNAP-tagTM自我标记反应
通过SNAP-tagTM(图3所示土黄色)与底物——苯甲基鸟嘌呤的特异性作用实现标记过程。SNAP-tagTM所带的活性巯基位点接受了苯甲基鸟嘌呤所携带的侧链苯甲基基团,释放出了鸟嘌呤。这种新型硫醚键共价结合使SNAP-tagTM所携带的目标蛋白(图3所示蓝色)间接携带上了苯甲基基团所带的标记物(图3所示绿色)。
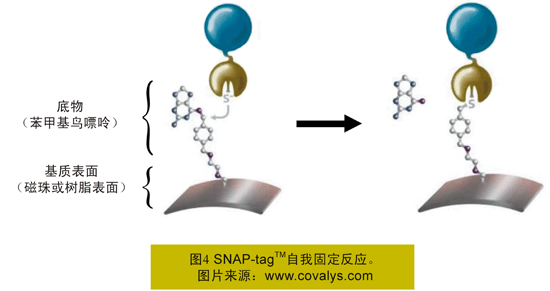
1.2.2 SNAP-tagTM融合蛋白快速固相化反应
SNAP-tagTM的底物——苯甲基鸟嘌呤,可事先固定在基质表面(图4所示褐色),然后混合提取液中的融合蛋白——SNAP-tagTM融合蛋白即可特异性地与底物作用,形成共价键,从而使得融合蛋白间接固定在基质表面。SNAP-tagTM融合蛋白快速固相化反应能快速固化蛋白,而无需纯化。
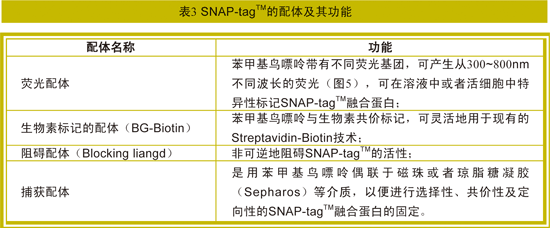
1.3 SNAP-tagTM的配体
在与底物发生反应的过程中,SNAP-tagTM的活性半胱氨酸和O6替代性鸟嘌呤之间形成了稳定的硫醚键。每一个SNAP-tagTM只与单个底物分子反应一次,SNAP-tagTM可与相当多种类的底物作用,不同的配体可以实现不同的功能和应用(表3)。
1.4 SNAP-tagTM的应用
1.4.1 SNAP-tagTM在蛋白质相互作用研究领域的应用
SNAP-tagTM可通过种类繁多的配体,轻松实现低通量的蛋白相互作用研究(pull down)和高通量的蛋白相互作用研究(均相时间分辨荧光分析法,Homogenous Time Resolved Fluorescence, HTRF),并且可用于高亲和力和低亲和力的蛋白质相互作用研究。
1.4.1.1 通过pull down进行蛋白相互作用研究
(1)FKBP-FRB相互作用——高亲和力
雷帕霉素(Rapamycin)是一种重要的免疫抑制剂,可用于抗癌治疗,同时也可广泛应用于研究领域。雷帕霉素可以抑制来自雷帕霉素蛋白(TOR)靶标的下游信号。在雷帕霉素的各种功能中,最为重要的是,它可以同时与两种不同的蛋白质——FKBP和mTOR的FRB结构域结合。
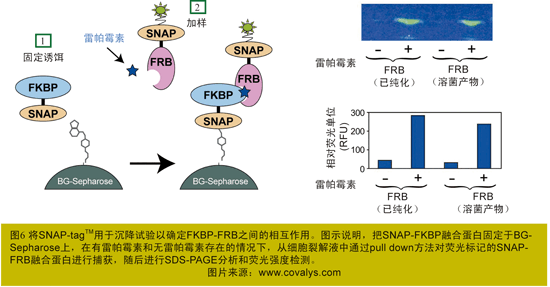
当FKBP-SNAP与BG-琼脂糖凝胶共价结合后,遇上被荧光探针标记的FRB-SNAP时,如果雷帕霉素存在,FRB和FKBP之间就会发生特异性相互作用;如果雷帕霉素缺失,FRB与FKBP只能发生较弱的相互作用(图6)。
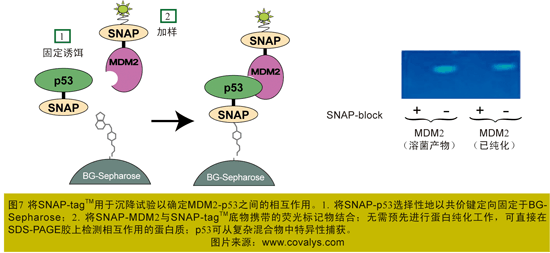
(2)MDM2-p53相互作用——低亲和力
肿瘤蛋白MDM2是一种E3泛素连接酶,也是p53肿瘤抑制蛋白最重要的细胞拮抗剂。同时,它还是肿瘤药物研发中一个已被验证过的靶标。MDM2与p53结合,并通过蛋白酶促进p53降解。已有研究表明,抑制p53与MDM2的相互作用,可致使某些癌细胞死亡(图7)。
1.4.1.2 通过HTRF进行蛋白相互作用研究
SNAP-tagTM易于标记带有HTRF荧光基团的蛋白质。HTRF促进了以时间分辨能量转移为基础的高敏感性近似检测的发展。
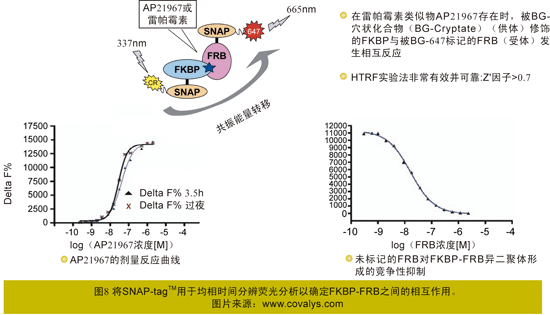
(1)通过HTRF进行FKBP-FRB相互作用研究——高亲和力
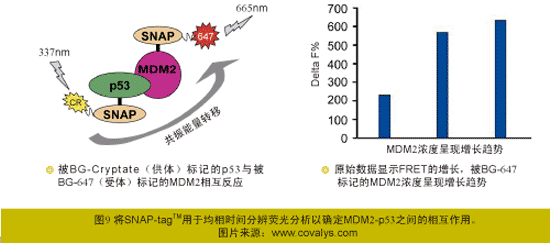
(2) 通过HTRF进行MDM2-p53相互作用研究――低亲和力
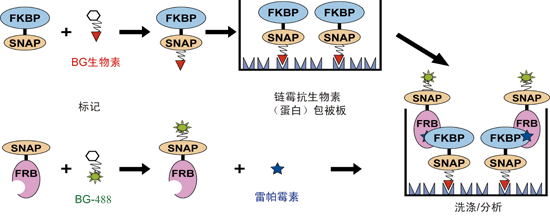
1.4.2 将SNAP-tagTM用于融合蛋白的生物素化和固相化
SNAP-tagTM的融合蛋白可通过共价键结合BG-biotin,从而在生理条件下实现生物素(酰)化。生物素化后的蛋白可轻松固定于链霉抗生物素包被的微孔板上(图10)。
1.4.3 将SNAP-tagTM用于蛋白固相化和纯化
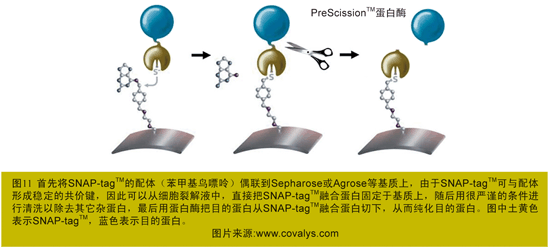
传统的蛋白纯化方法是基于标签蛋白与纯化基质之间不稳定的相互作用(亲和力),这就导致很多的融合蛋白由于结合力不够,没有结合在基质,损失了蛋白产量。此外,由于不能够用很严谨的条件进行清洗,又导致了很高的背景。而SNAP-tagTM用于纯化则可克服上述缺点(图11、12)。
1.4.4 将SNAP-tagTM用于活细胞中融合蛋白的标记
将SNAP-tagTM用于活细胞中融合蛋白标记技术的特点是:生物素、荧光素以及若丹明标记的底物,可渗入细胞,有利于进行体内蛋白标记;可应用于多种实验,例如蛋白定位、蛋白动力学以及脉冲追踪实验等;SNAP-tagTM配体都是小分子化合物,它们容易进入细胞,且对细胞没有毒害,因此带有各种荧光基团的配体就非常适用于细胞成像。目前商业化的荧光标记配体见表4。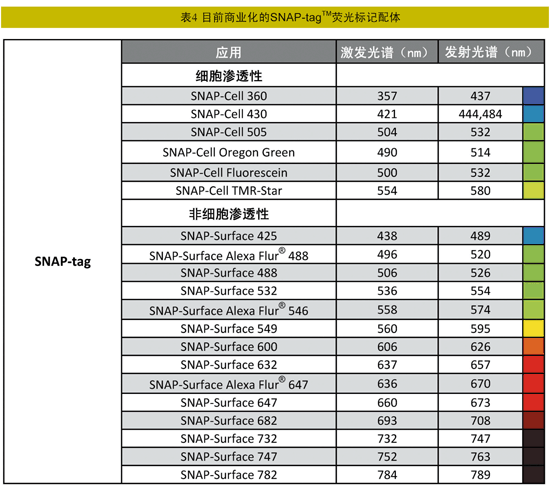
1.4.5 SNAP-tagTM ORF表达克隆及其应用
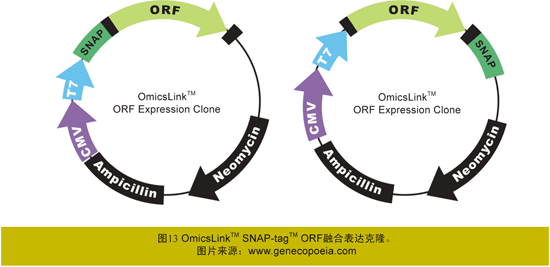
在生物学条件下,通过SNAP-tagTM进行共价标记,是一种精确的、高特异性的、可替代抗体捕获或标记及化学法标记的新技术。这使得快速有效的蛋白质与蛋白质相互作用研究领域的工作成为可能,同时也促进了对于蛋白质通过共价键特异性地固定于细胞表面方面的研究。但是,SNAP-tagTM必须与目的基因构建融合表达克隆才能发挥其威力。广州复能基因有限公司对SNAP-tagTM的融合表达载体进行了优化,并构建了人类、小鼠的编码基因ORF与SNAP-tagTM融合表达克隆(http://www.genecopoeia.com/product/snap-tag/)(图13),研究人员可选购各种SNAP-tagTM ORF融合表达克隆,直接进行下游的研究工作。
总之,SNAP-tagTM技术中可用于标记的底物的广泛程度及应用范围是其它技术方法无可比拟的。
原文检索:
http://www.covalys.com/
http://www.fulengen.com/
http://www.sciencedaily.com/releases/2008/02/080222143826.htm
Keppler A, Pick H & Arrivoli C et al. (2004) Labeling of fusion proteins with synthetic fluorophores in live cells. Proc Natl Acad Sci USA, 101(27): 9955-9.
小词典
Z’因子
Z’因子是一个关于信号区间和变异的组合,它已成为评估测试方法质量的主要参数。
Z’因子于1999首次发表以来,已被视为一个非常有用的评估试验的统计学方法。
Z’=1-3x(SDs+SDb)/[MS-MB](SD=标准、s=信号、b=背景)
Z’因子的值是一个用于区分信号与背景群体的相对指标。
Z’因子是一个没有量度的参数,其范围可以从1到小于0。
当Z’因子等于零时,信号与背景开始重叠。一般而言,可以接受的Z’因子应大于0.4。此时,S/B是3、CV是4%。S/B越高,变异也越大。通常CVs必须小于20%,尽管转化的S/B与较小的变异相关,但通常为了保证低于5%的CVs,S/B不应低于2。
为了评价分配质量和取消一些带明显误差的数据,在测试方法的建立、确证和高通量筛选的过程中,Z’因子都应在单个反应板基础上进行评估。
一、 新型蛋白标签
蛋白标签应用极为广泛,但仍有两个问题不容忽视:(1)蛋白标签以DNA形式编码,它需要转录并翻译成蛋白后才能发挥作用,而这种作用方式本身就是一种缺陷。例如,常用的荧光蛋白标签,在显微镜下观察时,其显像不如人工合成的荧光基团好,但是这种人工合成的荧光基团却无法通过遗传学操作与目的蛋白进行融合表达;(2)每一种标签一般只适用于一种用途,蛋白的纯化、检测、定位等往往需要不同的蛋白标签。对此问题有一种解决办法,那就是开发一种标签,使其再与各种人工合成的“二级标签”结合,例如荧光基团或亲和基团等等,以实现多种不同的应用。
现在已经出现了多种新型蛋白标签,它们都可以与一系列人工合成的配体形成共价键。这些配体包含两种关键结构:(1)反应连接体,即一个蛋白标签反应连接部位,其作用是启动与蛋白标签的共价键的形成;(2)功能报告体,即一个功能报告基团,如荧光染料或亲和反应基团等,通过不同的功能报告基团这种“二级标签”形式,以实现不同的功能(图1)。
随着这类新型蛋白标签及其相应配体的出现,研究人员可选择具有不同荧光的配体对胞内蛋白进行特异性标记。因此,活细胞内的世界逐渐变得更为清晰和丰富多彩;而且与其它标签技术同时使用,可以同时对两个或两个以上的不同蛋白进行标记,从而实现可视化监测。此外,新型蛋白标签的出现,还有助于人们鉴别某一活细胞内的新老蛋白。
接下来,本专题主要介绍几种常用的新型蛋白标签:SNAP-tagTM、CLIP-tagTM、ACP-tagTM、MCP-tagTM以及Halo-tagTM。
1. SNAP-tagTM――一种新型的自我标记标签蛋白
1.1 SNAP-tagTM简介
O6-鸟嘌呤烷基-DNA烷基转移酶(O6-alkylguanine-DNA alky¬ltransferase, AGT)是一种核蛋白,它通过把烷基化DNA链上鸟嘌呤O6-位的烷基转移至自身活性中心的半胱氨酸上,来行使DNA修复功能。严格来讲,AGT不算是一种酶,因为在生理条件下,转移反应只能进行一次,且不可逆。洛桑理工学院(Ecole Polytechnique Fédérale de Lausanne)Kai Johnsson博士科研小组发现,AGT可以特异性并快速地与苯甲基鸟嘌呤(benzylguanine, BG)衍生物发生反应,以共价键结合。随后,通过对AGT进行突变改造,研究人员获得了一种不与DNA链上的鸟嘌呤进行反应的蛋白,该蛋白不再定位于细胞核中,但与小分子BG衍生物的亲和力却大大地提高,而且只有22KDa大小。现在,研究人员赋予了它一个广为人们接受的名字——SNAP-tagTM。
1.1.1 SNAP-tagTM的优点
SNAP-tagTM无论在体内还是体外都可以特异性并快速与其配体,即BG衍生物发生特异性反应,以共价键结合。由于BG可带各种不同的其它化学基团,如生物素、荧光素(fluorescein)、若丹明(rhodamine)等,从而实现一种标签蛋白可以被多种配体标记,是一种具有**性意义的自我标记蛋白标签。
SNAP-tagTM大小为22kDa,在很多常见表达系统中都能够良好表达。目前为止,已有相当数量和种类的蛋白质作为N末端和C末端SNAP-tag融合蛋白被成功表达出来。SNAP-tagTM在蛋白质标记中具有三大优势(表1),可以广泛应用于蛋白标签的各个应用领域,是一种非常理想的蛋白标签。此外,反应的基本原理决定了SNAP-tagTM具有三大优点(表2)。
1.1.2 SNAP-tagTM功能
SNAP-tagTM功能多样,可以应用于各种不同的研究,主要包括:可在活细胞或细胞提取物中快速标记融合蛋白;可将蛋白质共价固定于固相介质表面,而无需进行之前的纯化工作;可与蛋白酶配合,在把融合蛋白固定化后,纯化目的蛋白,捕获蛋白复合物;可直接在SDS-PAGE胶中检测SNAP-tagTM融合蛋白(图2)。
1.2 SNAP-tagTM技术原理
1.2.1 SNAP-tagTM自我标记反应
通过SNAP-tagTM(图3所示土黄色)与底物——苯甲基鸟嘌呤的特异性作用实现标记过程。SNAP-tagTM所带的活性巯基位点接受了苯甲基鸟嘌呤所携带的侧链苯甲基基团,释放出了鸟嘌呤。这种新型硫醚键共价结合使SNAP-tagTM所携带的目标蛋白(图3所示蓝色)间接携带上了苯甲基基团所带的标记物(图3所示绿色)。
1.2.2 SNAP-tagTM融合蛋白快速固相化反应
SNAP-tagTM的底物——苯甲基鸟嘌呤,可事先固定在基质表面(图4所示褐色),然后混合提取液中的融合蛋白——SNAP-tagTM融合蛋白即可特异性地与底物作用,形成共价键,从而使得融合蛋白间接固定在基质表面。SNAP-tagTM融合蛋白快速固相化反应能快速固化蛋白,而无需纯化。
1.3 SNAP-tagTM的配体
在与底物发生反应的过程中,SNAP-tagTM的活性半胱氨酸和O6替代性鸟嘌呤之间形成了稳定的硫醚键。每一个SNAP-tagTM只与单个底物分子反应一次,SNAP-tagTM可与相当多种类的底物作用,不同的配体可以实现不同的功能和应用(表3)。
1.4 SNAP-tagTM的应用
1.4.1 SNAP-tagTM在蛋白质相互作用研究领域的应用
SNAP-tagTM可通过种类繁多的配体,轻松实现低通量的蛋白相互作用研究(pull down)和高通量的蛋白相互作用研究(均相时间分辨荧光分析法,Homogenous Time Resolved Fluorescence, HTRF),并且可用于高亲和力和低亲和力的蛋白质相互作用研究。
1.4.1.1 通过pull down进行蛋白相互作用研究
(1)FKBP-FRB相互作用——高亲和力
雷帕霉素(Rapamycin)是一种重要的免疫抑制剂,可用于抗癌治疗,同时也可广泛应用于研究领域。雷帕霉素可以抑制来自雷帕霉素蛋白(TOR)靶标的下游信号。在雷帕霉素的各种功能中,最为重要的是,它可以同时与两种不同的蛋白质——FKBP和mTOR的FRB结构域结合。
当FKBP-SNAP与BG-琼脂糖凝胶共价结合后,遇上被荧光探针标记的FRB-SNAP时,如果雷帕霉素存在,FRB和FKBP之间就会发生特异性相互作用;如果雷帕霉素缺失,FRB与FKBP只能发生较弱的相互作用(图6)。
(2)MDM2-p53相互作用——低亲和力
肿瘤蛋白MDM2是一种E3泛素连接酶,也是p53肿瘤抑制蛋白最重要的细胞拮抗剂。同时,它还是肿瘤药物研发中一个已被验证过的靶标。MDM2与p53结合,并通过蛋白酶促进p53降解。已有研究表明,抑制p53与MDM2的相互作用,可致使某些癌细胞死亡(图7)。
1.4.1.2 通过HTRF进行蛋白相互作用研究
SNAP-tagTM易于标记带有HTRF荧光基团的蛋白质。HTRF促进了以时间分辨能量转移为基础的高敏感性近似检测的发展。
(1)通过HTRF进行FKBP-FRB相互作用研究——高亲和力
(2) 通过HTRF进行MDM2-p53相互作用研究――低亲和力
1.4.2 将SNAP-tagTM用于融合蛋白的生物素化和固相化
SNAP-tagTM的融合蛋白可通过共价键结合BG-biotin,从而在生理条件下实现生物素(酰)化。生物素化后的蛋白可轻松固定于链霉抗生物素包被的微孔板上(图10)。
1.4.3 将SNAP-tagTM用于蛋白固相化和纯化
传统的蛋白纯化方法是基于标签蛋白与纯化基质之间不稳定的相互作用(亲和力),这就导致很多的融合蛋白由于结合力不够,没有结合在基质,损失了蛋白产量。此外,由于不能够用很严谨的条件进行清洗,又导致了很高的背景。而SNAP-tagTM用于纯化则可克服上述缺点(图11、12)。
1.4.4 将SNAP-tagTM用于活细胞中融合蛋白的标记
将SNAP-tagTM用于活细胞中融合蛋白标记技术的特点是:生物素、荧光素以及若丹明标记的底物,可渗入细胞,有利于进行体内蛋白标记;可应用于多种实验,例如蛋白定位、蛋白动力学以及脉冲追踪实验等;SNAP-tagTM配体都是小分子化合物,它们容易进入细胞,且对细胞没有毒害,因此带有各种荧光基团的配体就非常适用于细胞成像。目前商业化的荧光标记配体见表4。
1.4.5 SNAP-tagTM ORF表达克隆及其应用
在生物学条件下,通过SNAP-tagTM进行共价标记,是一种精确的、高特异性的、可替代抗体捕获或标记及化学法标记的新技术。这使得快速有效的蛋白质与蛋白质相互作用研究领域的工作成为可能,同时也促进了对于蛋白质通过共价键特异性地固定于细胞表面方面的研究。但是,SNAP-tagTM必须与目的基因构建融合表达克隆才能发挥其威力。广州复能基因有限公司对SNAP-tagTM的融合表达载体进行了优化,并构建了人类、小鼠的编码基因ORF与SNAP-tagTM融合表达克隆(http://www.genecopoeia.com/product/snap-tag/)(图13),研究人员可选购各种SNAP-tagTM ORF融合表达克隆,直接进行下游的研究工作。
总之,SNAP-tagTM技术中可用于标记的底物的广泛程度及应用范围是其它技术方法无可比拟的。
原文检索:
http://www.covalys.com/
http://www.fulengen.com/
http://www.sciencedaily.com/releases/2008/02/080222143826.htm
Keppler A, Pick H & Arrivoli C et al. (2004) Labeling of fusion proteins with synthetic fluorophores in live cells. Proc Natl Acad Sci USA, 101(27): 9955-9.
小词典
Z’因子
Z’因子是一个关于信号区间和变异的组合,它已成为评估测试方法质量的主要参数。
Z’因子于1999首次发表以来,已被视为一个非常有用的评估试验的统计学方法。
Z’=1-3x(SDs+SDb)/[MS-MB](SD=标准、s=信号、b=背景)
Z’因子的值是一个用于区分信号与背景群体的相对指标。
Z’因子是一个没有量度的参数,其范围可以从1到小于0。
当Z’因子等于零时,信号与背景开始重叠。一般而言,可以接受的Z’因子应大于0.4。此时,S/B是3、CV是4%。S/B越高,变异也越大。通常CVs必须小于20%,尽管转化的S/B与较小的变异相关,但通常为了保证低于5%的CVs,S/B不应低于2。
为了评价分配质量和取消一些带明显误差的数据,在测试方法的建立、确证和高通量筛选的过程中,Z’因子都应在单个反应板基础上进行评估。