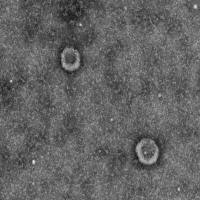
免疫电镜胶体金标记法
互联网
金标法是Faulk和Taylor(1971)提出的,并首先用于免疫电镜。它是利用胶体金在碱性环境中带有负电的性质,使其与抗体相吸附,从而将抗体标记。当用金标记的抗体与抗原反应时,在光镜水平胶金液呈现鲜艳的樱红色,不需加外进行染色。
在电镜水平,金颗粒具有很高的电子密度,清晰可辨。因此,免疫电镜胶体金标记法近年来被成功地应用于生物学的各个方面,并取得了要喜的进展,解决了一些过去未能解决的问题,80年代以来似有取代免疫电镜PAP技术的趋势。
胶体金标记抗体技术在电镜水平应用有许多优点:首先,手续不如PAP法烦琐,不需用H2O2等损伤微细结构的处理步骤,对微细结构的影响较少。其次,金颗粒具有很高的电子密度,在电镜下金颗粒清晰可辨,易于与其他免疫产物相区别。因此,金标法还可以和PAP法相结合进行双重或多重染色的超微结构定位。
另外,利用不同直径的金颗粒标记不同的抗体,是研究突触小泡内神经递质共存的有力工具。由于抗原抗体反应部位结合金颗粒数量的多少可进行粗略的免疫细胞化学定量研究。金标抗体还可加入培养液中,对培养细胞内抗原进行标记定位。曾有报告用金标记法于细胞内骨架的研究获满意的效果。
由于金具有强烈的继发电子的能力,因此,不仅可以用于透射电镜的超薄切片观察,也可以用于扫描电镜对细胞表面的抗原、受体进行标记定位观察。金标液无毒性,对人体无损伤。胶体金及胶体金标记物的制备见第五章 第3节 。在原位分子杂交技术在电镜水平的应用中,胶体金的标记术被科技工作者认为是当前最理想的标记物。
一、电镜水平的免疫金染色法
应用于电镜水平的免疫法,可分为包埋前染色和包埋后染色,由于包埋前染色对细胞膜的穿透性差,一般只用于细胞表面的抗原标记,如需穿透细胞膜,则需辅以冻融法或加入Triton X-100、皂素等活性剂,后者会加重细胞超微结构的破坏,因此,现较普遍采用包埋后染色,现分别介绍如下:
1、包埋后染色
(1)超薄切片厚50~70nm左右,载于200~300网孔的镍网上。
(2)置1%H2O2内10min至1h(视树脂的硬度和切片的厚度而定),以去锇酸和增进树脂穿透性,有利抗体进入。如切片很薄或于低温包埋时,此步可省略。操作时,滴入1%H2O2液1滴于蜡板上,将网的载片面轻浮于液滴上。对中枢神经系统切片,有主张以1%过碘酸钾(KIO4)代替H2O2的。
(3)双蒸水洗3次,每次10min,第1,2次洗法如(2),浮于液滴上,第3次以盛双蒸水的注射器沿镍网面冲洗,水流应有适当压力,但不宜过高强,用滤纸在网缘将水吸干。
(4)浮于正常羊血清(1:50~1:100)滴上,室温30~60min,以饱和固定剂中的游离醛基占据非特异性结合部位。
(5)PBS漂洗3min,洗1次(有人主张不洗)。
(6)滤纸吸干,孵育于第一抗体血清滴上,先室温预孵1h,再置于4℃24~36h.
(7)PBS漂洗3min,3次。
(8)PBS(内含1%的牛血清白蛋白)pH8.2中,5min,此步为胶体金结合作准备。
(9)胶体金标记抗体液1:30~1:100,淡红色为适宜稀释液,室温孵育10min至1h.
(10)双蒸水洗3min,3次。
如作双重染色,则应将镍网翻过来,用另一类抗体血清,重复上述步骤(2)~(10)。
(11)5%醋酸铀(双蒸水配制)染5min,然后用双蒸水洗。
(12)枸橼酸铀(或醋酸铅)染色5min,双蒸水洗净。
(13)电镜观察。
2、包埋前染色
(1)组织经过适当固定,为增强细胞穿透性,可在固定液中加入皂角素(Saponin),使其浓度为0.01%,经含皂角认固定剂处理5~8min后,应用0.01mol/l PBS Ph7.4冲洗12h左右,中间换洗3~4次。
(2)组织切片贴于明胶涂抹的坡片上,细胞可制成混悬液,用离心法操作或制成涂片。
(3)0、05mol/l PBS pH7.4洗3min.
(4)以1:5正常羊血清处理切片30min室温,以阻断非特异性吸附。
(5)第一抗体4℃孵育20h后室温2h或过夜。
(6)0、05mol/l TBS pH7.4洗3min×3.
(7)0、02mol/l TBS pH8.2洗3min×3,为与胶体金结合作准备。
(8)再次阻断非特异性吸附,同(4)。
(9)以金标记的第二抗体(工作浓度1:40左右)在室温下孵育1h.
(10)0、05mol/l TBS pH8.2洗3min.
(11)0、05mol/l TBS pH7.4洗3min×3
(12)1%锇酸(0.1mol/l PBS溶液)1h.
(13)双蒸水洗15min.
(14)系列酒精或丙酮脱水,包埋、超薄切片。(15)枸椽酸铅对照染色。
为增加抗非特异性染色,有的实验室倾向在TBS中加入1%小牛血清白蛋白(Bovine Serum Albumin, BSA, Sigma)。理想的免疫金染色切片,背景应清洁,无残留的金或其他无机盐颗粒,金粒集中在抗原、抗体反应部位。
要获得理想的免疫金染色切片,需注意的因素很多,其中主要的如:
①抗体血清的高度特异性和亲和力;
②被检组织应有较高浓度的抗原;
③冲洗液的清洁度,冲洗的彻底程度以及整个过程中应用的各种器皿的清洁度等;
④所有溶液最好用微孔滤过器(milipore filter滤过),滤膜孔径0.2~0.45μm,所有器皿应清洁和专用。整个操作过程应在湿盒内进行,以使载网保持湿润。
二、胶体金标记蛋白A技术(Protein A-gold technique, PAg法)
在电镜水平应用较为广泛,因该法具有特异性中、灵敏度高、方法简便和背景染色淡等优点。蛋白A的免疫特异性在第五章 已作了介绍,PAg复合物制备方法简便,作为第二抗体,无种属特异性,可以免去不同种属动物要制备不同的特异性免疫球蛋白。
PAg 复合物与包埋剂和细胞成分都极少发生非特异性的交互作用,蛋白A和金粒间非共价的结合特性既不影响蛋白A的活性,又能保持高度的稳定性,PAg复合物分子最小易于穿透组织。
1、蛋白A-金(PAg)复合物的制备(Slot 和Geuze,1981)
(1)胶体金液的制备,应用枸椽酸三钠还原法(见第五章 )。
(2)待标记蛋白质和金溶液的准备,同前。注意点是用0.2mol/l K2CO3将金溶液pH调至5.9~6.2之间。
(3)确定胶体金与蛋白A的结合用量比例。取一系列盛有0.1ml胶体金液的小玻璃管,分别加入不同量的蛋白A,5min后,再各加0.25ml 10%的NaCl.如加入的蛋白A浓度不够,不能稳住金粒,在电解质NaCl的影响下,金粒聚合沉淀,溶液由红变蓝。
选择能防止溶液由红变蓝的最低浓度的蛋白A的量作为两者的结合比例。以枸椽酸钠法制成的胶体金每毫升约需要5μg蛋白A来结合,方能保证其稳定性。
(4)胶体金与蛋白A的结合和纯化,依上法测得所需的比例超过10%,即每30ml胶体中加入2mg蛋白A,5min后,加入0.3ml PEG作为稳定剂,然后以15000r/min离心45min(不同方法制备的金离心速度不同),略带红色的松散的复合物沉淀即为PAg复合物。小心弃去上清液,加入PBS冲洗,如上,松散的PAg复合物置于PBS溶液中,按0.2mg/ml的比例加入聚乙二醇作为稳定剂,保存于硅化的玻璃器皿中备用,也有主张将上述PAg复合物放入3~6ml 5%甘油—0.05%聚乙二醇—0.02%叠氮钠混合液中,再离心,弃去无色上清液后,收取管底部浓缩纯化的PAg复合物置4℃保存。
据文献报告,此PAg复合物的原液在4℃可保存达一年之久。
2、电镜水平的PAg染色法 PAg法在电镜技术的应用原则是二步标记法,可用于包埋前和包埋后染色。其主要区别于一般胶体金免疫染色在:①须1%卵白蛋白—PBs (pH7.4)或1%卵白蛋白—0.05mol/l Tris缓冲液(pH7.4)来封闭非特异性的结合部位,而不是采用羊或其它的动物的正常抗血清,因为PAg复合物能够与正常血清组中的Ig结合,从而给出假阳性结果;②在应用第一抗血清孵育和PBS冲洗后作第二抗血清即PAg复合物孵育前的准备时,应用的PBS或TBS的pH应变更为pH7.4.在变更这两步后,其它可参照本节 中包埋前、后染色法进行。也可采用下列步骤进行包埋后染色。
(1)载有超薄片的镍网或金网浮于1%卵白蛋白—PBS液滴上,室温约5min.
(2)载网不冲洗,直接移至第一抗血清液滴上,在室温孵育2h或4℃18~24h.
(3)PBS冲洗3min×2次。
(4)将PAg原液稀释10~20倍,载网浮于该液滴上,室温孵育1h.
(5)PBS冲洗5min×2次。
(6)5%醋酸铀水溶液染色,水洗。
(7)枸椽柄铅染色。
(8)电镜观察。
三、胶体金双标记技术(常用为蛋白A—胶体金)
1、单面法以不同直径的金粒分别标记两种不同的抗体,以间接法先染第一种抗体,洗净后再染第二抗体。
2、双面法以不同直径的金粒标记的抗体于镍网的两面分另进行免疫染色。本法的优点是可防止两种金标记的抗体的相互干扰,又可防止第一次应用的一抗与其相应的抗原相结合,占据了空间,第二次应用的抗体没有适合的空间使之与相应的抗原相结合。
3、异种动物抗原—抗体染色法如一抗分别用人与兔抗血清,人抗组织抗原A,兔抗组织抗原B.第二抗体分别以不同直径金粒标记的抗人和兔免疫球蛋白。由于种属不同,两种抗血清不会互相干扰,在应用一抗和二抗时都可将两种血清一次混合使用,将四步减少为两步。
4、金标记抗原检查法(Gold—labelled antigen detection method, GLAD 法)此法是Larson(1977)年首先提出的,应用放射性同位素如125I或酶标记抗原进行染色。先用特异性抗体与组织抗原反应,标记的纯抗原又与特异性抗体反应。Larson(1980,1981)又在此基础上提出应用胶体金在电镜水平进行双抗原甚至多抗原定位。GLAD原理是:双价的Ig抗体分子过量地加到有抗原的组织切片上,使分子的两个抗原结合点中有一个结合到组织抗原上,而另一端可与标记金的抗原起反应。双标记时,预先将两种不同的抗原标以不同直径的金粒,可分别与相应的第一抗体相结合,从而显示出两种抗原在组织切片的定位。此法的优点是标记物所显示出的组织抗原的部位经过两次选择,标记了抗原只能与相应的特异性抗体相结合而不能与切片中非特异性Ig相结合,因此具有较高的特异性。但由于使用此法时需备有与欲检抗原相同的纯抗原,并要对不同抗原分别进行标记,非一般实验室所能做到,所以至今尚未被广泛应用。
双面金标记法操作程序(Cai et al 1993, 改良自Bendayan et al 1982)。
(1)镍网面A(树脂包埋)
①蒸馏水冲10min.
②10% H2O2蚀刻10min室温
③10%正常血清(以0.5mol/l Tris缓冲液pH7.4、含1%BSA和2%Tween20 稀释,简称TBT缓冲液)室温30min.
④以滤纸吸去多余液体,覆于特异性第一抗体1:500(Tris 缓冲液,pH7.4,含1%BSA和0.1%叠氮钠)4℃,孵育过夜
⑤彻底清洗,应用0.5mol/L Tris缓冲液pH7.2,不含BSA
⑥继之用0、5mol/L Tris缓冲液pH7.6,含1%BSA冲洗
⑦0、5mol/L Tris缓冲液pH8.2,含1%BSA,室温孵15min
⑧羊抗兔IgG标记以15nm金粒,应用0.5mol/l Tris缓冲液pH8.2、含1%BSA稀释1:40,孵育2h,室温
⑨0、5mol/L Tris缓冲液pH7.4 冲洗
⑩蒸馏水冲洗
(2)镍网面B,重复①~⑩,只在第④时更改另一特异性一抗,在⑧时羊抗兔IgG标记以5nm金粒。
(3)铀铅双重染色,电镜观察,可见二种不同直径金粒标记。
注意事项:①所有溶液均须经加有微孔滤纸(0.45μm孔,国内外现均有商品提供)的注射器过滤,过滤后直接以注射器冲洗。②滤纸最好用无纤维吸水滤纸。③冲洗在胶金标记技术上是个决定性关键,仅次于抗体血清的纯度。笔者的体会是一般应漂洗3×5min,以注射器喷水漂洗效果优于杯漂洗法,但漂洗水流需与网面平行,勿使水压破坏切片。
四、免疫电镜金—银法染色技术
关于免疫金银细胞化学的原理、试剂配制和光镜显示技术在本书第五章 已作了较详尽的叙述。免疫金银细胞化学技术说可应用于电镜水平。一般用于包埋前染色。其主要操作步骤如下:
(1)组织固定振动切片机切片10~30μm.
(2)人3%正常羊血清,含0.1%Triton X—100 的PBS孵育30min,以封闭非特异性结合部位
(3)1%硼氢化钠的PBS孵育30min.
(4)一抗37℃,2h.
(5)PBS含0.1%BSA pH7.4 冲洗3min×3次。
(6)PBS含0.1%BSA pH8.2 冲洗3min×3次。
(7)人10~15nm金标羊抗兔抗血清,工作浓度约1:10,37℃孵育45min.
(8)硝酸银液物理显影(详见第五章 第六节 )。
(9)在解剖显微镜下取免疫反应阳性部位,人1%锇酸后固定20min,常规脱水,树脂包埋。
(10)超薄切片机切0.1μm左右半薄切片,定位阳性反应部位,制超薄切片。如有暗视野微镜则更有助于定位。在暗视野前景下,金银粒呈金黄色闪光颗粒,即使微量金银也可定位,微镜则更有助于定位。在暗视野前景下,金银粒呈金黄色闪光颗粒,即使微量金银也可定位。
(11)铀—铅电镜染色,电镜观察。
免疫金银法敏感度高,金银颗粒电子密度高,反差强;应用包埋前染色可先定位阳性反应部位再作电镜超薄切片,获得阳性反应机率高,特别适用于含微量抗原的部位,如突触等。其不足是须经暗室显影,手续较烦杂,包埋前免疫染色易增加非特异性染色。另外,由于单个金粒周围结合的银粒不是固定的,受多种因素影响。因此,电镜免疫金粒染色法的金粒银粒计算不适于做半定量观察,误差较大。