胶体金标记物的制备
互联网
胶体金标记蛋白质的原理,一般认为是由于pH值等于或稍偏碱于蛋白质等电点时,蛋白质呈电中性,此时蛋白质分子与胶体金颗粒相互间的静电作用较小,但蛋白质分子的表面张力却最大,处于一种微弱的水化状态,较易吸附于金颗粒的表面。
由于蛋白质分子牢固地结合在金颗粒的表面,形成一个蛋白层,阻止了胶体金颗粒的相互接触,而使胶体金处于稳定状态,如果=低于蛋白质的等电点时,蛋白质带正电荷,胶体金带负电荷,二者极易静电结合形成大的聚合物。
如果pH高于蛋白质等电点时,蛋白质带负电荷,与金颗粒的负电荷相互排斥而不能互相结合。为防止蛋白质与胶体金的聚合与沉淀,常用牛血清白蛋白,卵白蛋白,聚乙二醇或明胶作稳定剂。用Sephacryb S—400 (丙烯葡聚糖S—400 )层析分离纯化胶体金蛋白标记物只适用于以BSA作稳定剂者。
一、待标记蛋白质的准备
(1)透析除盐:蛋白质溶液内应除去多余的电解质,不然过高的盐类物质会降低胶体金颗粒的Zeta电位,影响蛋白质的吸附,因此,标记之前必须彻底除盐。一般将蛋白质置入透析袋中然后直接放入双蒸水或极低浓度的盐水(0.005mol/L NaCl , pH7.0)透析。
(2)去除蛋白质中的沉淀:长期低温保存的蛋白质或4℃较长时间保存的抗体,特别是在浓度高于2mg/ml的情况下,很容易形成聚合物,聚合物对标记过程及免疫金探针的稳定性有一定影响,因此,标记之前须离心以除去这些聚合物。一般以100000r/min 4℃离心60min取上清液,调整蛋白质浓度至1mg./ml即可用于标记。
二、胶体金pH值的调整
胶体金与蛋白质的结合成功与否,取决于pH值,一般只有在蛋白质等电点(PI)略偏碱的条件下二者才能牢固地结合,因此,标记之前须将胶体金溶液的pH值调至待标记蛋白质的等电点略偏碱。
需要提高胶体金的pH值时可用0.1molK2CO3,需要降低胶体金的pH值时可用0.1N HCl.测定金溶液的pH可能损害pH测定计的探头,因此,一般用精密的pH试纸测定其pH即可。
几种常用的蛋白质标记时胶体金所用的pH值见表5-4.
表5-4 常用几种蛋白质标记时胶体金所用的pH值如下
蛋白质 | pH |
抗体(γ球蛋白) | 9.0 |
亲合层析的IgG | 7.6 |
单克隆抗体 | 8.2 |
F(ab')2 | 7.2 |
SPA(葡萄球菌蛋白) | 6.0 |
蓖麻子植物凝血素Ⅰ | 8.0 |
蓖麻子植物凝血素Ⅱ | 8.0 |
花生凝集素 | 6.3 |
Helix pomatia lectin | 7.4 |
大豆凝集素 | 6.1 |
Lens Culinaris lectin | 6.9 |
Lotus Tetragonolobus lectin | 6.3 |
荆豆凝集素 | 6.3 |
Bandeirae simplicifolia lectin | 6.2 |
过氧化物酶 | 8.0 |
类卵粘蛋白 | 4.8 |
血浆铜兰蛋白 | 7.0 |
α-胎球蛋白 | 6.5 |
小牛血清白蛋白 | 6.5 |
牛血清白蛋白 | 5.5 |
牛血球白蛋白结合肽 | 4.5 |
牛血清白蛋白结合胰岛素 | 5.3 |
霍乱毒素 | 6.9 |
破伤风毒素 | 6.9 |
DNAase | 6.0 |
RNAase | 9.0 |
低密度脂蛋白 | 5.5 |
α2-巨球蛋白 | 6.0 |
抗生物素蛋白(亲合素) | 10.0 |
链霉抗生物素蛋白 | 6.6 |
麦胚凝集素 | 9.9 |
三、待标记蛋白质最适稳定量的测定
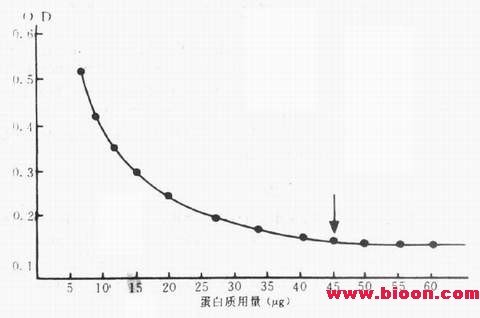
(1)光电比色法:制备一系列不同浓度的等体积蛋白质溶液(1ml),分别加入5ml胶体金中,迅速混匀,然后,各加入1ml 10% NaCl溶液,摇匀,静置5min后测各管。根据胶体金颗粒的大小,OD在520~580nm之间测定,以OD值为纵坐标,蛋白质用量为横坐标作一曲线,取曲线最先与横轴相接近的那一点处的蛋白质用量为最适稳定量。图5.2中10nm的胶体金溶液中蛋白质的最适稳定量为45μg/ml。

图5-2 蛋白最适稳定量示意图
(2)目测法:以目测法确定胶体金与待标记蛋白质用量比例,将标记的蛋白质逐级稀释后(由5μg~45μg另设对照管),各取等体积顺序加入一系列装有1ml胶体金的试管中,5min后,在上述各管内分别加入0.1ml 10%氯化钠,依表5-5顺序进行。
表5-5 具体的做法是按表内进行
①当分别加入0.1ml 10%氯化钠后、混匀静置2h以上观察结果。
②没有加入蛋白质的管为对照管。
③小于5nm颗粒的胶体金溶液,每个管内应加入5μl33%的双氧水,否则有不变蓝色及聚沉现象。未加蛋白及加入蛋白量不足以稳定胶体金的试管,即呈现由红变蓝的聚沉现象,而加入蛋白量达到或超过最低稳定量的试管则胶体金的红颜色不变。其中含蛋白量最低的试管即含稳定1ml胶体金的必须蛋白量。在此基础上再加上20%即为稳定所需蛋白质的实际用量。
四、蛋白质的胶体金标记
当蛋白质的最适稳定量及标记的最佳pH值被确定以后便可进行标记。具体步骤如下:
(1)根据用以标记的胶体金的总量计算出所需要的待标记蛋白质的总量。
(2)在电磁搅拌下,将蛋白质溶液加入胶体金溶液中(pH已调至PI超过0.5pH),加入蛋白质时应逐滴加入,1mg的蛋白质大约5min加完。
(3)在磁性搅拌下加入5%的牛血清白蛋白(BSA)使其终浓度为1%,或加入3%聚乙二醇(PEG MW20000)使其终浓度为0.05%, 我们对比了BSA和PEG稳定胶体金的效果,BSA稳定的标记胶体金,放在4℃达2年半仍然保持良好性能,而用PEG稳定的标记胶体金放在4℃1年左右就有分层现象,而且染色效果显著下降。因此,我们认为最好还是用BSA作稳定剂。
(4)将标记好的胶体金装入透析袋中,两头扎紧,放入蔗糖或硅胶中浓缩,浓缩到原体积的1/10量,浓缩完毕后纯化。离心法纯化时,不要浓缩。
五、胶体金标记蛋白质的纯化
标记好的免疫金探针必须经过纯化处理以后才能用于免疫细胞化学染色。纯化的目的是除去其中未标记的蛋白质,未充分标记的胶体金以及在标记过程中可能形成的各种聚合物。
(一)调整与超速离心法
(1)将标记的大于10nm的胶体金溶液选用15000r/min 4℃离心15min,吸出上清,弃去沉淀,以去除大的聚合物。
(2)一般在10nm以上所标记的胶体金均可在调整离心机上离心,小于10nm颗粒的胶体金用超速离心机离心,在4℃离心1h左右,弃上清,将沉淀以原体积的0.02mol./L TBSpH8.2(内含1%BSA,0.05%叠氮钠)溶解,重复离心2~3次,沉淀溶于原体积的1/10TBS中。4℃保存备用。为了得到颗粒均匀一致的免疫金试剂,上述粗提制剂可用10%~30%蔗糖或甘油溶液作密度梯度离心,分带收集不同大小颗粒的胶体金标记蛋白制剂。
几种免疫金探针离心所用转速(见表5-6),离心纯化时所用转速见表5-7,胶体金的OD值见表5-8。
表5-6 几种免疫金探针离心时所用转速参考表
说明:GAR IgG=羊抗兔IgG;RAM IgG=兔抗鼠IgG;ALcc IgG=抗肝细胞癌IgG; SPA=葡萄球菌A蛋白
表5-7 几种免疫金探针离心纯化时所用转速
将纯化好的胶体金用0.02mol/L TBS缓冲液作1:20稀释,用520nm测OD值。
表5-8 不同大小胶体金的OD值
(二)凝胶过滤法
为纯化免疫金探针的最好方法,其特点是简便,过滤的胶体金颗粒比较均匀,不容易凝集,而离心方法转速高,时间长,胶体金颗粒沉淀容易凝集,用凝胶过滤克服了这一弱点。选用本方法时胶体金溶液必须用牛血清白蛋白作稳定剂。具体操作过程如下:
(1)将浓缩好的胶体金以1500r/min离心去掉大的聚合物。吸出上清待过柱。
(2)柱高34cm,直径1cm,加样体积为柱床体积的1/10。
(3)丙烯葡聚糖S-400(Sephacryls—400 , Pharmacia, Sweden)装柱后用0.02mol/L pH8.2 TBS平衡层析柱(pH7.4者用于标记的SPA),平衡好后,吸取上清胶体金液体加入层析柱内,加样时请注意不要破坏S—400的界面。
(4)用0.02mol/L pH8.2 TBS洗脱,先行滤出的液体有少量微黄不透亮的液体,紧接着是浓度高红色而透亮的胶体金,注意颜色的变化,如红色变淡,变黄立刻停止收集。如Sephacryls—400没有,也可以用Sepharose –4B或6B代替(Pharmacia, Sweden)也能收到较好的效果。
六、免疫金探针的鉴定
(1)用有Formvar 膜的镍网沾取金标蛋白溶液,空气中干燥后醋酸铀复染,在TEM下观察,可见金颗粒周围有一明显的空晕,表示颗粒表面吸附有蛋白质分子。
(2)纯化后免疫金探针是否保持很好的生物学活性是判断其质量好坏的主要指标,因此,在使用之前必须对它的特异性,敏感性进行鉴定。鉴定举例,用阳性抗原片,脱蜡至水,胰蛋白酶消化,加第一抗体(多克隆或单克隆),一般过夜再加标记抗同一抗特异性抗体结合的胶体金溶液(多克隆或单克隆抗体标记的胶体金)详细方法步骤见后IgGS法,一般做1:2,1:4,1:8,1:16,稀释SPA-金,做1:10,1:20,1:40,1:80稀释,37℃ 45min,冲洗,显色,观察结果,染色效价以阳性结果明确,背景浅的稀释度为标准。免疫细胞化学染色试验可以较全面地反应免疫金探针的质量。