实验动物的灌注固定原理和技巧
丁香实验
|
灌注固定主要用于神经系统,其他组织意义不是很大,而且耗时耗力。对神经系统防止变性效果较好! |
一、小鼠灌注
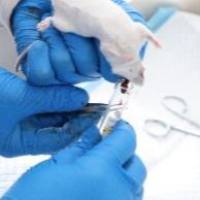
灌流固定小鼠时我一般采用输液器的针头(4 号半,这样肉眼可见就是肺部明显充气胀大变白,针头要从心轴方向进针,刺入心尖 3~4 毫米左右就可以了,开始灌流后剪破右心耳,约 40 毫升生理盐水,后再灌流约 20 毫升多聚甲醛,整个灌流固定的过程就完成了。
二、大鼠灌注
按大鼠体重,用 2% 戊巴比妥钠(0.25ml/100g)进行腹腔注射麻醉,开胸暴露心脏,向左心室内注射 1% 肝素钠 0.2ml 后经左心室行主动脉插管, 血管钳固定后剪开右心耳,先以生理盐水 150ml 快速冲洗血管,然后用4%多聚甲醛的 0.01mol/LPBS(4℃,PH7.40)250ml 灌注固定,先快后慢,共需时间为 50min,之后取材,置4%多聚甲醛固定液后固定,在 4℃ 冰箱内保存。多聚甲醛进入大鼠体内,大鼠会出现四肢、尾的抽搐,最终以肝脏发白、内脏鼓起即灌注好。
三、脑组织免疫组化实验
1. 灌注固定用的针头,一般都用注射针头。灌注大鼠一般可用10到12号针头,小鼠可用 6、7 号针头,但很重要的一点是要把针头的尖端磨钝而不是用锐利的针头。
2. 关于穿刺:灌注大鼠时要把穿刺针的尖端插入到升主动脉内,但不宜进入升主动脉过长,在动脉内见到针头或插入约1mm左右即可;灌注小鼠时只要把针头插入左心室内即可,不必要插入到升主动脉内。
操作的要点是:
第一,操作要迅速,剪开膈肌后,迅速沿腋前线剪开胸壁,并把胸前壁往上翻,暴露心脏;第二,一定要在明视野下操作,要剪开心包壁层的前壁,暴露升主动脉和肺动脉干的根部,确保穿剌针能进入升主动脉;
第三,穿刺之前要用适当大小的血管钳夹住心室以固定心脏,但不要夹得过紧,要让心腔内留有一定的间隙,然后在心尖处轻轻旋转针头插入穿刺针。也可以用小剪刀在心尖处先剪开一个小口再插入穿刺针;
第四,穿刺方向要正确,从心尖部开始,从左下方斜向右上方,若遇阻力要改变方向再试,不要用力蛮插。
3. 灌注用生理盐水的量大鼠用 50ml 左右,小鼠用 10ml 左右,一般以从右心耳流出的液体清亮为标准;4%多聚甲醛用量约相当于老鼠体重,如 300 克的老鼠用 300ml 左右。小鼠一般用 20-30ml。灌注速度先快后慢,可持续 1-2 个钟头,也可以稍快。取脑后置脑块于 4% 多聚甲醛内4度后固定 4-6 个钟头。
四、难点与关键点
将灌注针插入主动脉内是灌注固定的关键,也是难点。首先准确找到主动脉,这是此步骤的要点。可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心 外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。
插入时动作要慢,针尖方向不要偏向右侧,以免刺入右心房,如果感到有阻力,则将针退后、调整方向重新进针,直到进入主动脉,灌注针进入主动脉后可在心脏的上方看到其位置,灌注针进入主动脉的长度最 好为 3~5 毫米,然后用丝线扎紧。
切勿将灌注针放在左心室内,这样由于主动脉瓣的关闭,灌注液很难进入主动脉,而是沿着心室的切口流出,致使灌注失败。另外,灌注针插入成功后,一定要用剪刀剪开右心耳而不是右心室,这是灌流液的出口。剪开心尖的位置一定要掌握好,不能偏右使灌注针插入右心室。
五、注意事项
1. 针头大小与动物的种类有关,同时针头一定要磨钝。
2. 检查灌注泵的运作情况,一定排出管子的气泡和空气,防止空气栓塞。
3. 经腹腔暴露胸腔,先清楚升主动脉外面的脂肪组织和心外膜组织。
4. 将针头经左心室插入升主动脉(颜色变白的哦),并用钳子固定。
5. 解开右心耳,同时开启灌注泵。注意,不要随便揭开心脏的其他部位,否则有时候可能会灌注成功但是绝大部分会造成灌注不成功,尤其肺水肿。
6. 将 4 度的生理盐水(最好已动物的肝脏发白为标准,我们实验室的大鼠约用 250ml)和多聚甲醛(根据所取得材料而定)依次灌入。
7. 整个过程均应将动物放在冰上,以便于最大程度的保存目的蛋白和酶的活性。