样品体积增加后,对蛋白质的纯化效率有怎样的影响?
IBA生命科学
在蛋白纯化的过程中,你是否遇到过这样的情形:分泌到真核细胞培养基上清中的标签蛋白,纯化时非常的具有挑战性?
实验用到的高密度细胞培养基,会将 IMAC 填料上的固定化金属离子剥离,导致在蛋白纯化的过程中,纯化效率较低。除此之外,目的蛋白浓度较低也增加了纯化的复杂程度,较大的上样体积,从而又导致了金属离子的脱落,使得纯化难度增加。
那么,上样体积会对纯化效率产生怎样的影响?
在之前的蛋白结构解析前沿进展线上沙龙中,IBA Lifesciences 的蛋白质产品与分析总监 Dennis Karthaus, 分享了他们的实验。

一、实验设计
选择三种经常用到的表达系统:
Expi293TM – protein expression in HEK293 cells
ExpiCHOTM - protein expression in CHO cells
ExpiSfTM – protein expression in insect cells
纯化过程中,选择柱体积为 0.2 ml 的三种纯化柱:Ni Sepharose 6 FastFlow, Ni Sepharose Excel, 和 Strep-Tactin®XT 4Flow®。
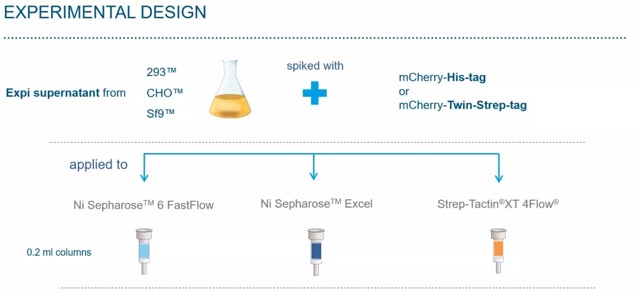
分别用其纯化 60CV (column volume, 柱体积) 和 120CV 的样品,并保持上样样品中的蛋白质含量在纯化柱最大结合载量 80%-95 %。

二、实验结果
对于不同的填料,可以从洗脱组分中回收到多少的蛋白呢?
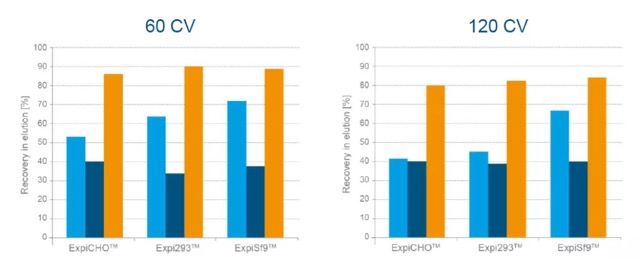
 (Recovery– STREP-TAG® OUTPERFORMS HIS-TAG)
(Recovery– STREP-TAG® OUTPERFORMS HIS-TAG)
实验发现,使用 Strep-Tactin XT® 4Flow®进行纯化时,回收效率明显高于使用 Ni-NTA 进行的纯化。Strep-Tactin® XT 4Flow®可以回收得到 80%-90% 的蛋白,并且增大上样体积后,纯化效果不受影响。
相对而言,上样体积增加后,则会对使用标准 Ni-NTA 的纯化实验产生影响,但对使用 Ni Sepharose Excel 纯化的蛋白回收效率不产生影响,而总体的回收效率却比较低。
02 对比洗脱得到蛋白量
如果转而将洗脱得到蛋白量加以对比,可以发现标准 Ni-NTA 柱结合的蛋白量最多,当然这得益于其填料特性——优异的结合载量。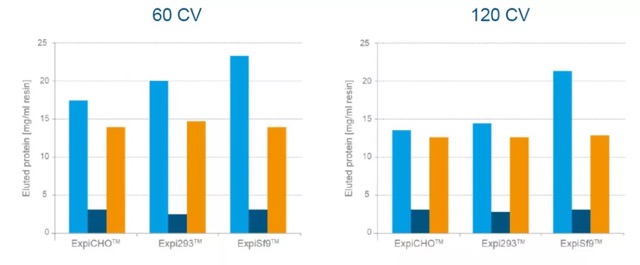 (CAPACITY – STANDARD Ni-NTA INFLUENCED BY LOADING VOLUME)
(CAPACITY – STANDARD Ni-NTA INFLUENCED BY LOADING VOLUME)
但如果上样体积 120CV,其与 Strep-Tactin® XT 的差异并不明显。同时,Karthaus 和他的团队也提出了这样的问题:样品中如果蛋白含量不同,是否还会得出以上结论呢?
03 样品中蛋白质浓度影响因素
在接下来的实验中,他们将纯化样品中的蛋白含量调整为填料最大结合载量的 50%(之前为 80%),相对等于样品中的蛋白质浓度降低了。
但而后发现,降低了样品中蛋白浓度后,使用 Ni-NTA 纯化的蛋白回收率也随之降低了。结果表明,Ni-NTA 并不适用于从 Expi Supernatants 中纯化目的蛋白。

Sampleconcentration impacts Ni-NTA purification
04 蛋白质与填料接触时间影响因素
由于实验使用的是 0.2 ml 的填料体积进行纯化,并且又在重力条件下进行,无法对流速加以调整。对于 Ni Sepharose Excel 填料而言,回收率低的原因是否又与以上有关?
接下来的实验使用 1 ml 的 Ni Sepharose Excel 填料的纯化,从而使得样品在填料中的停留时间的以增加到约 1 min 左右。实验发现,停留时间增加后,回收到蛋白的量也得以有了提高。 POOR EXCEL RESIN’s RECOVERY – RESIDENCE TIME MATTERS
POOR EXCEL RESIN’s RECOVERY – RESIDENCE TIME MATTERS
Strep-Tactin®XT 和 Twin-Strep-tag®的高亲和力,与 Ni Sepharose Excel 相比而言,Strep-Tactin®XT 的纯化效果仍具有显著优势。
05 Strep-Tactin®XT 优异的纯化效率
下面真实的实验中拍摄的图片,相信更能帮助大家理解。
最新一代的 Strep-Tag®蛋白纯化系统因 Strep-Tactin®XT 与 Twin-Strep-tag® 具有极佳亲和力 (pM),成为了全方位的蛋白研究工具。
以上内容整理自蛋白结构解析前沿进展线上沙龙分享内容,实验数据来自 IBA Lifesciences。










