盐作为日常食物的重要组成部分,对身体的内环境平衡有非常重要作用。摄入过量的盐往往会导致许多的心血管系统和肾脏相关疾病。
2019 年著名医学杂志 Lancet 发表 2017 年全球疾病研究系列报告,指出全球不良饮食相关的死亡中,有三大因素分别为高盐饮食,全谷类摄入不足和水果摄入不足。在我国因不良饮食而导致的心血管疾病死亡率高居世界前列。于是,人们普遍认为减少盐的摄入量是一种合乎逻辑的治疗心血管健康的方式。
高盐饮食除了引起心血管相关疾病,同样也会诱导自身免疫性疾病的发生,如近年来发病率激增的多发性硬化症(MS)。有研究表明高盐饮食通过改变肠道菌群和增强 TH17 细胞分化,从而加剧了人工诱导的中枢神经系统自身免疫疾病。然而目前并没有证据表明盐的摄入与自发性自身免疫疾病相关。
2021 年 3 月 15 日,德国马克思普朗克生化研究所 Gurumoorthy Krishnamoorthy 团队在 PNAS 上在线发表题为 High-salt diet suppresses autoimmune demyelination by regulating the blood–brain barrier permeability 的研究成果。

图片来源:PNAS
该研究发现在自发性中枢神经系统自身免疫疾病(spontaneous central nervous system autoimmunity)的小鼠模型中,高盐饮食(HSD)抑制了自身免疫性疾病的发展。
HSD 的摄入增加了血清循环中糖皮质激素皮质酮的水平。从而增强了脑内皮细胞上紧密连接分子的表达,促进血脑屏障 (BBB) 的收紧,从而控制炎症 T 细胞(inflammatory T cells)进入中枢神经系统(CNS)。这些结果证明了适度增加盐的摄入可能对中枢神经系统自身免疫性疾病有益。
主要内容
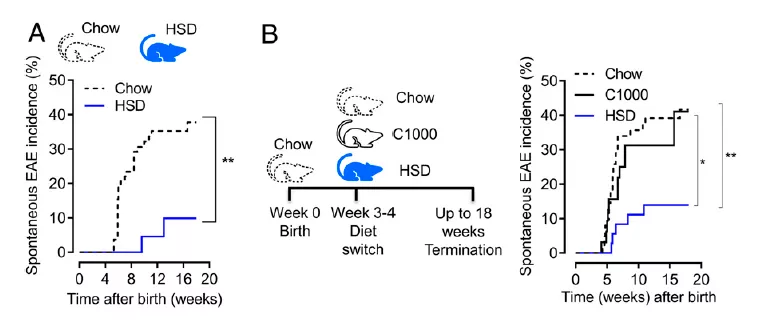
研究团队使用视神经脑脊髓炎(OSE)小鼠模型来检测 HSD 对自身免疫性脱髓鞘疾病的影响。
研究发现,在 HSD 喂养的 OES 小鼠群体中,神经学症状的发病率显著降低。普通的 OSE 组中大约 40% 出现自发性的实验性自身免疫性脑脊髓炎(EAE),而在 HSD 组中只有不到 9% 的自发性的实验性自身免疫脑脊髓炎发病率。
为了进一步确定 HSD 对自身免疫性疾病的抑制是否与生命早期发育中未知的生理变化有关,研究人员在小鼠断奶后进行了饮食切换实验。同样发现,相对于粗糙或精致的饮食,HSD 对自身免疫性疾病有显著的保护作用。
图片来源:PNAS
先前报道在主动诱导的实验性自身免疫脑脊髓炎模型中, HSD 可通过改变微生物群和增强 TH17 细胞分化,加剧人工诱导的中枢神经系统 (CNS) 自身免疫疾病。这与发现 HSD 对 CNS 自体免疫疾病的保护作用相反。于是,研究团队进行了对比实验,结果发现 HSD 抑制自发性的实验性自身免疫脑脊髓炎,但并不影响人工诱导的实验性自身免疫脑脊髓炎。
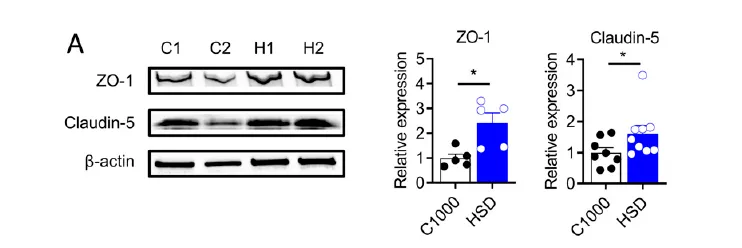
为了进一步探究 HSD 介导的自发性的实验性自身免疫脑脊髓炎保护机制,研究团队首先关注了先前报道的免疫系统的改变。但是在肠道与脾脏中并没有发现任何免疫类型的细胞具有显著的改变。于是,推测 HSD 在自发性与主动诱导的实验性自身免疫脑脊髓炎中的不同,可能是由于改变了 BBB 的结果,而蛋白表达结果显示 HSD 喂养组脑内皮细胞的 BBB 连接分子 ZO-1 和 claudin-5 的表达显著升高。因此,研究人员将目光主要集中在可能改变 BBB 的循环组分上。
图片来源:PNAS
在人类与小鼠中,高盐的摄取会导致盐皮质激素和糖皮质激素水平发生改变,检测发现 HSD 组小鼠血清中肾上腺皮质酮(糖皮质激素)升高。在肾上腺中,发现 cyp11b2 的表达水平显著降低,而其功能是将皮质酮转化成醛固酮,因此表明血清中升高的皮质酮是由于其代谢减弱所导致的。
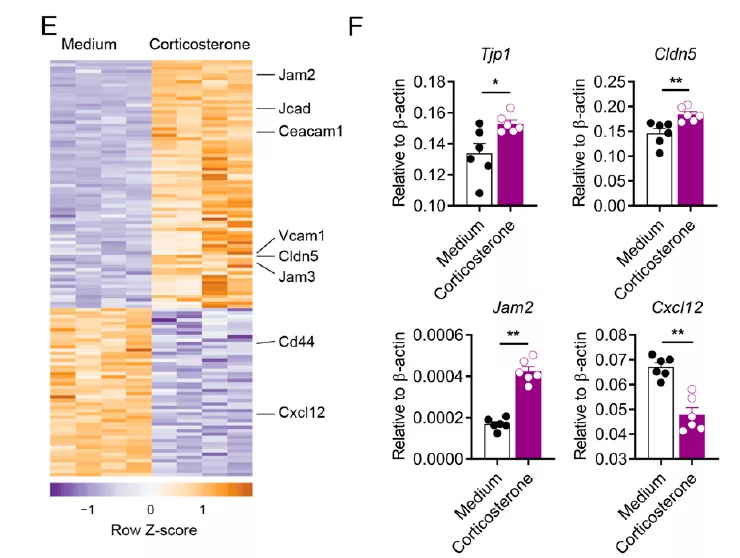
那么皮质酮是否对内皮细胞 BBB 有影响呢?转录组与蛋白组的分析发现,皮质酮刺激导致 BBB 收缩相关的细胞黏附基因 Cldn5,Jam2 和 Jcad 的表达水平显著升高,而影响 T 细胞进入 CNS 的趋化因子 Cxcl12 表达降低。既然建立了 HSD 与 BBB 的关系,研究团队进一步体内体外实验验证了 HSD 会导致 BBB 收缩。
图片来源:PNAS
研究总结
该研究发现了盐的摄入抑制了自发性的实验性自身免疫脑脊髓炎的发病率,通过促进血脑屏障的收缩与防止炎症 T 细胞进入中枢神经系统,从而抑制了神经系统疾病的发展。强调了高盐摄入量对自身免疫性疾病易感性的多种影响。
近些年来高盐饮食相关研究引起学者们的广泛关注,大多数发现高盐饮食在各个方面都有着不利的影响。例如,2013 年 Nature 报道题为 Sodium chloride drives autoimmune disease by the induction of pathogenic TH17 cells 文章,发现高盐会影响自身免疫性疾病;
2019 年 Nature Medicine 发表题为 Chronic inflammation in the etiology of disease across the life span 论文,发现 高盐会影响肠道菌群的变化;
2019 年 Gastroenterology and hepatology 报道题为 The global, regional, and national burden of stomach cancer in 195 countries, 1990–2017: a systematic analysis for the Global Burden of Disease study 2017, 发现高盐饮食会加重胃溃疡与胃癌的风险;

2020 年 Science Translational Medicine 在线发表 A high-salt diet compromises antibacterial neutrophil responses through hormonal perturbation,发现 过量摄入盐会减弱免疫系统的抗细菌能力。

但无独有偶的是 2020 年 Nature Communications 发表 High-salt diet inhibits tumor growth in mice via regulating myeloid-derived suppressor cell differentiation 研究论文, 表明高盐饮食可以通过调节髓系抑制性细胞(MDSC)的活性,从而激活抗肿瘤免疫监视,抑制小鼠肿瘤的生长。
高盐饮食对人体健康还有没有其他有利的方面,还需要进一步的研究。部分研究表明高盐饮食在某些方面有利,并不意味着我们在平常生活中要高盐饮食。
本周推荐:
1. Shin-Young Na et al. High-salt diet suppresses autoimmune demyelination by regulating the blood–brain barrier permeability. PNAS, DOI: https://doi.org/10.1073/pnas.2025944118. 2. M. Kleinewietfeld et al. Sodium chloride drives autoimmune disease by the induction of pathogenic TH17 cells. Nature, DOI: https://doi.org/10.1038/nature11868.3. Furman, D et al. Chronic inflammation in the etiology of disease across the life span. Nat Med, DOI: https://doi.org/10.1038/s41591-019-0675-0.4. GBD 2017 Stomach Cancer Collaborators et al. The global, regional, and national burden of stomach cancer in 195 countries, 1990–2017: a systematic analysis for the Global Burden of Disease study 2017. Gastroenterology and hepatology, DOI: https://doi.org/10.1016/S2468-1253(19)30328-0.5. Katarzyna Jobin et al. A high-salt diet compromises antibacterial neutrophil responses through hormonal perturbation. Science Translational Medicine, DOI: 10.1126/scitranslmed.aay3850.6. He Wei et al. High-salt diet inhibits tumour growth in mice via regulating myeloid-derived suppressor cell differentiation. Nat Commun, DOI: https://doi.org/10.1038/s41467-020-15524-1.