还在用试剂盒提取质粒的你,懂得它背后经历了什么吗?
丁香园
说起提取质粒,想必是做分子生物学的搬砖工们每天的常规工作。随着各大公司开发出各种质粒提取 kit,为苦逼的生物狗带来了福音—试剂再也不用自己配了,提取步骤再也不用那么繁琐了。
但,你先别着急高兴,久而久之,很多刚进实验室的小白师弟师妹再也不懂得背后的原理:质粒提取出来掺杂有蛋白或者基因组 DNA 怎么办?待转染或酶切的质粒被有机溶剂污染了怎么办?且听我一一道来。
质粒是独立于基因组外的小型环状 DNA 分子,能够自我复制,在分子克隆中是最常用的外源基因载体。在自然状态下,质粒常存在于细菌中,携带对宿主在某些特殊情况下的抗性基因,例如抗生素抗性基因。
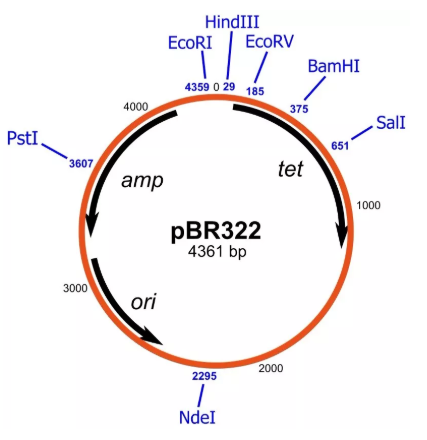
举个栗子,如图所示,这是质粒 pBR322 的示意图,第一个被广泛用作基因载体的质粒。不仅能够独立自主复制(ori),而且在多克隆位点(Multiple cloning sites)处可以插入想要表达的目的基因,将插入目的基因的质粒转化到细菌或真核细胞中,在合适的条件下目的基因便可得到表达。
为了方便验证转化是否成功,质粒上还带有筛选标记——抗性基因,在质粒 pBR322 中是 amp 和 tet 抗性。在转化后,向培养基中加入 amp 或 tet,能够生长的菌株就是成功转化的。
说了这么多,我们怎么得到这么好的质粒呢?下面我想大家介绍一种最经典,也是最灵活的质粒提取步骤和每个步骤的原理。
细菌的培养
1. 从琼脂 LB 平板上挑取单菌落,接种到液体 LB 培养基中,过夜培养。
Tips:菌体里的质粒一般含有抗生素抗性基因,在细菌培养过程中要向培养基中加入相对应的抗生素,以防质粒丢失。
细菌的收获,裂解
细菌的收获一般通过离心进行,而细菌的裂解有多种方式,包括离子型 / 非离子型去污剂,有机溶剂,或者碱裂解,加热等。选择哪一种方式主要看质粒的大小,大于 15kb 的大型质粒要注意采用温和的方法(溶菌酶法),剧烈的方法容易使它收到破坏。
而小于 15kb 小型质粒则可采取相对剧烈的方法(碱裂解法或煮沸法)。由于我们平时 大多质粒都小于 15kb,所以今天主要讲最常用的碱裂解法小提质粒。
1. 将培养过夜的大肠杆菌培养液倒入 1.5 ml 小离心管中,在小离心机中 12 000 rpm,4 ℃ 离心 30 s。
2. 尽可能倒干培养液上清。
3. 将细菌沉淀,所得重悬于 100 μl 用冰预冷的溶液 I 中,剧烈振荡。
溶液 I
50 mmol/L 葡萄糖
25 mmol/L Tris HCl(pH8.0)
10 mmol/L EDTA(pH8.0)
Tips:这一步主要作用是重悬菌体,EDTA 是金属螯合剂,主要作用是防止下一步的裂解过程中内切酶对质粒进行切割。
4. 加入 200ul 新配置的溶液 II,盖紧管口,快速颠倒离心管 5 次,切勿震荡,将离心管置于冰上。
溶液 Ⅱ
0.2 mol/L NaOH(临用前用 10 mol/L 贮存液现用现稀释)
1% SDS
Tips:菌体在强碱性条件下裂解,释放出包括质粒在内的核酸,蛋白等物质。注意混匀要轻柔,否则基因组 DNA 裂解成小片段,有可能对质粒造成污染。SDS 作用是结合蛋白质,为下一步做准备。
5. 加 150μl 用冰预冷的溶液 Ⅲ,盖紧管口,将管倒置后温和地振荡 10 秒钟,使溶液 Ⅲ 在粘稠的细菌裂解物中分散均匀,之后将管置于冰上 3-5 分钟。
溶液 Ⅲ
5 mol/L 乙酸钾 60 ml
冰乙酸 11.5 ml
水 28.5 ml
Tips:这一步主要作用是中和,避免质粒长时间在碱性条件下造成损伤,此时质粒溶解在中和液上清中。SDS 的钾盐是不溶于水的,也直接导致与之结合的蛋白质沉淀,由于基因组 DNA 很大,而且与部分蛋白质结合,也造成了共沉淀。
6. 在小离心机中 12 000 rpm,4 ℃,离心 5 min,将上清转移到新离心管中。
Tips:经过离心,不溶的大分子核酸,蛋白质等物质被沉淀下去,而可溶的质粒在上清中。
7. 加等体积得酚: 氯仿,振荡混匀,用微量离心机于 4 ℃ 以 12 000 g 离心,上清转移到另一离心管中。
Tips:虽然经过沉淀可以去除大部分蛋白质,但还是有部分蛋白残留,所以利用蛋白质在酚中强烈变性,可以比较彻底的将蛋白质抽提掉。酚在水中微溶,所以加入氯仿,以便使酚溶解在有机相中。而且增加有机相的比重,离心后使水相和有机相更彻底的分开。吸取上清时,会看到明显的两相分界线,分界线上会看到薄薄的一层白色,这就是变性的蛋白质,注意不要吸到上清中。如果用的是酚的水溶液抽提,那么还要再加上一步氯仿抽提,以除去残留的酚,否则会致使酶切,PCR 等反应不能正常进行。
质粒的回收
1. 用 2 倍体积的无水乙醇于室温沉淀质粒。振荡混合,于室温放置 2 分钟。
Tips:乙醇沉淀 DNA 的优点是,它可以与水任意比例混溶,而且不与质粒发生反应,顺便还可以溶解去除上一步的有机溶剂,在高浓度盐的溶液中,加入无水乙醇更容易让质粒沉淀。
2. 在小离心机中 12 000 rpm,4 ℃,离心 5 min,收集沉淀的质粒。
3. 小心倒去上清液,将离心管倒置在纸巾上,排干残留的无水乙醇。
4. 加入 1 ml 的 70% 乙醇水溶液,盖紧盖管,颠倒数次,在小离心机中 12 000 rpm,4 ℃,2 min,回收质粒。
Tips:在质粒提取过程中,溶液 I,II,Ⅲ 中的盐还残留在离心管中,这一步主要作用是溶解残留的盐,质粒沉淀在下面,达到提纯的效果。
5. 倒掉上清,倒置在纸巾上,在空气中将酒精溶液会发干净,直到试管中没有可见液体。
Tips:注意一定要将酒精溶液挥发干净,否则同样影响进一步的酶切等反应。这里有个小技巧送给大家,小编平时如果急用的话,会把 EP 管放进超净台,打开通风,这样 15 min 左右就完全挥发干净啦。
6. 加入 50 ul 的去 RAN 酶和 DNA 酶的 TE 溶液震荡重新溶解质粒,储藏于 -20 ℃ 备用。
Tips:如果有灭菌的蒸馏水也是可以的。