消灭疟疾
最近发表的研究表明,来自大肠杆菌的毒素可能是治疗脑疟疾的治疗工具。
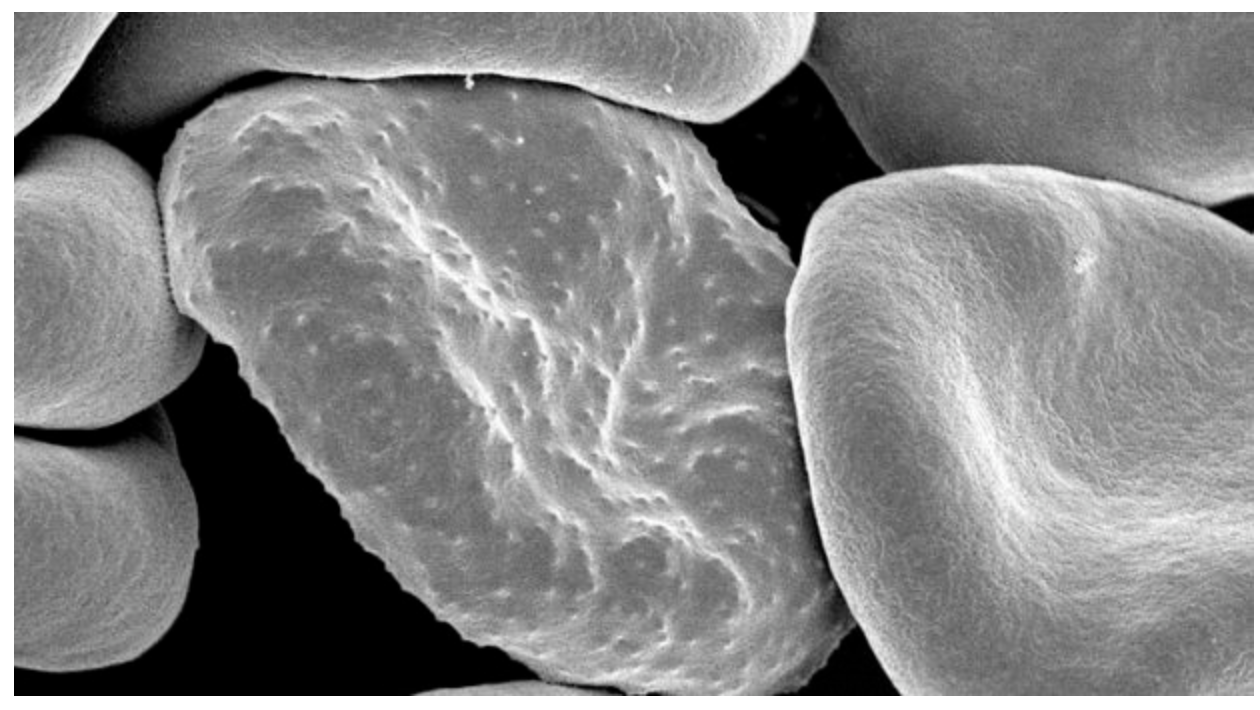
恶性疟原虫是最致命的疟原虫之一,它能使受感染的红细胞粘附在血管内皮细胞上,包括为大脑服务的血管内皮细胞。这一过程被称为细胞粘附,与被称为脑疟疾的疾病的严重症状的发展有关。
脑疟疾的定义是不可治愈的昏迷症状和寄生红细胞的存在。尽管只有1%的感染者表现出这些症状,但其中90%是儿童。那些幸存下来的人患有神经系统疾病。脑疟疾可与多器官衰竭一起发生,如果不加以治疗,可能在数小时内导致死亡。
虽然脑疟疾的病因尚不清楚,而且很可能是多种多样的,但它与在大脑小血管中隔离受感染的红细胞(iRBCs)有关。这导致微血管阻塞和到达组织的氧气不足。
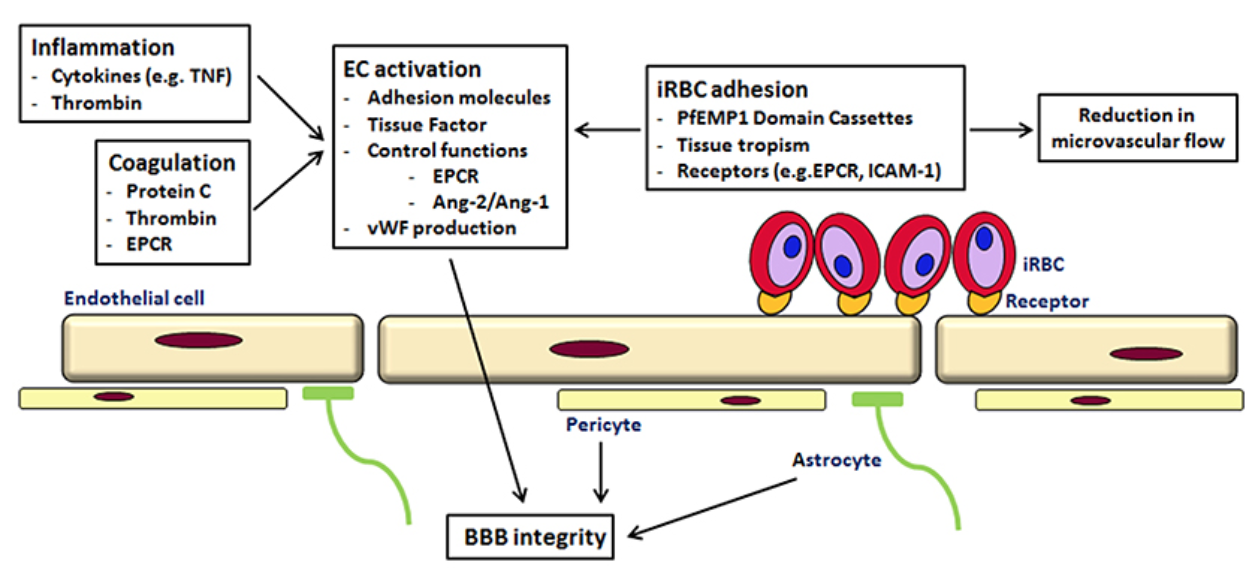
细胞粘附
一些寄生虫起源的分子已经被证实与细胞粘附有关。它们被输出到iRBCs表面,聚集在称为结节的突起中,并与内皮细胞表面表达的粘附分子结合。这种结合被发现通过Rho激酶激活Rho激酶信号通路,Rho激酶是一个小的gtpase家族,充当分子开关。这种激活可以触发内皮细胞的变化,影响血脑屏障。
一些研究表明,逆转细胞粘附的治疗可以挽救生命,包括使用单克隆抗体治疗阻断配体-受体相互作用。
新方法
来自大肠杆菌的蛋白毒素,细胞毒性坏死因子1(CNF1),已知调节某些Rho GTPases家族的活性,将它们锁定在激活它们的降解状态中。CNF1还可以防止细胞凋亡,改变细胞肌动蛋白骨架。
在最近的一篇文章中,梅西纳、洛伊佐和他的同事们报道了他们对CNF1作为iRBCs与内皮细胞粘附抑制剂的研究。
与内皮细胞共培养时,iRBCs粘附在其表面,为研究细胞粘附提供了体外模型。
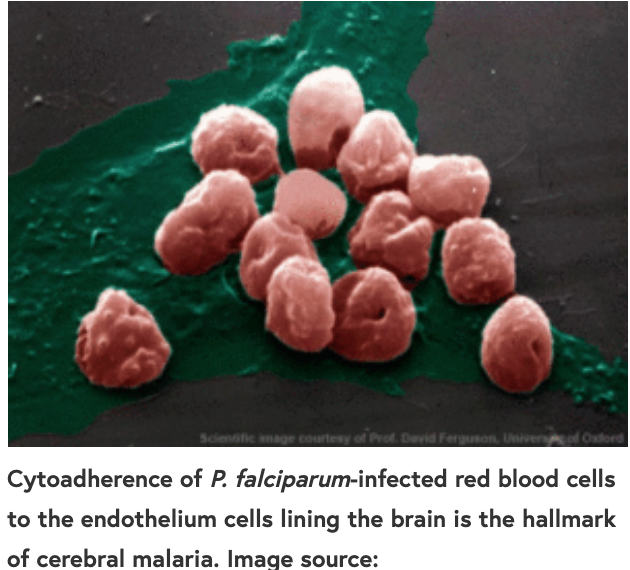
使用两个恶性疟原虫克隆和两种内皮细胞来源,研究人员证明,用CNF1预处理显著降低了克隆和内皮细胞系的所有组合的粘附力。此外,用CNF1处理iRBCs/内皮细胞培养物后,粘附在细胞系上的iRBCs数量显著减少。
他们已经证明,CNF1不仅可以阻止细胞粘附,还可以逆转细胞粘附。
什么是机制?
ICAM-1是iRBCs结合的内皮细胞受体之一。iRBCs将与被发现在塑料培养皿上的ICAM1结合。通过进行这些结合分析,无论是否有CNF1,研究者表明CNF1并没有通过干扰iRBCs与ICAM1的结合而起作用。
进一步的实验表明,CNF1对寄生虫没有毒性,也不影响RBC表面上的旋钮的表达。
CNF1确实降低了内皮细胞ICAM1的表达。但是,这只发生在治疗24小时后,寄生虫已经分离,这表明这不是它的作用方式。然而,CNF1确实影响内皮层的完整性及其作为屏障的能力。
血脑屏障由内皮细胞屏障的完整性维持。内皮细胞的高通透性是与脑疟疾相关的病理学的一部分。实验表明iRBCs的存在增加了内皮细胞层的通透性。如果在导入iRBCs之前将CNF1添加到培养基中,则可以防止这种情况;如果在iRBCs已经粘附到该层之后添加CNF1,则可以防止这种情况。因此,CNF1作用于内皮细胞,而不是寄生虫或iRBC。
CNF1对内皮细胞的作用
尽管CNF1对内皮细胞的活性没有影响,但它确实改变了内皮细胞的形态,导致细胞扁平和扩散。肌动蛋白细胞骨架也被重组和富集。这些细胞骨架的变化受Rho-GTPase家族成员的控制。
CNF1的存在提高了这些蛋白的活性,其中一种蛋白(Cdc42 GTPase)的活性提高了76倍。此外,抑制剂的使用证明,如果Rho激酶被抑制,细胞粘附不受CNF1的影响;如果Rho gtpase被抑制,CNF1也不能激活细胞骨架的重塑。
CNF1作为一种疗法
作者认为CNF1激活Rho-GTPase亚家族成员的能力引发了一系列影响内皮细胞形态、细胞粘附和ICAM-1下调的事件。
他们认为,CNF1作为一种治疗手段,可以启动iRBCs与内皮细胞的分离,阻止或阻断微血管的流动。这一点,加上它已知的抗神经炎症的能力和它的快速作用,表明它作为治疗脑疟疾并发症的单剂量药物的潜在吸引力。
另一个好处是内皮细胞是靶向细胞,而