一篇 Nature = 一家 5000 万美元的初创公司!蛋白靶向降解技术新秀,LYTAC 能否经受住时间考验
靶向蛋白降解技术
(Proteolysis TArgeting Chimeras, PROTAC) 乃是继小分子抑制剂(small molecule inhibitors, SMI)和单克隆抗体(monoclonal antibody, mAb)药物后的新兴热门药物研发领域。与后两者相比,PROTAC 具有独到的优势,能够靶向众多的以前认为「不可成药」的蛋白分子。迄今已有上百种 PROTAC 分子已经或者正在研制当中,众多的新兴创业公司也是顺势崛起。
然而,这种 PROTACs 蛋白降解技术也有其自身的局限性:除分子较大、PK不佳外,因为利用的是泛素降解系统、只能靶向细胞内蛋白。然而,很多有潜力的药物靶点通常是膜蛋白和分泌蛋白居多。膜蛋白和分泌蛋白占蛋白总数的 40%,且生长因子、细胞因子等细胞外蛋白可以通过与细胞表面的受体相结合,在多种疾病中引发异常信号传导。
那么,到底有没有一种靶向降解与疾病相关的细胞外蛋白的技术呢?
近日,来自斯坦福大学 Bertozzi 教授的研究团队在 Nature 发表题为:Lysosome-targeting chimaeras for degradation of extracellular proteins [1]. 的研究性论文。这项研究通过细胞膜上溶酶体靶向受体(LTR)的已知激动剂与抗体或小分子配体链接起来形成 LYTAC,LYTAC 可将结合的目标蛋白内吞到溶酶体进行降解。这个技术可以成功降解分泌蛋白和膜蛋白,包括 EGFR、CD71、PD-L1 等。

背景介绍
真核细胞内蛋白质降解的主要位点是溶酶体和蛋白酶体。与蛋白酶体途径不同,蛋白质降解的溶酶体途径不限于细胞内的蛋白质。据报道,细胞表面溶酶体靶向受体(LTR)可促进蛋白质向溶酶体的运输。因此,研究提出能够同时结合细胞表面 LTR 和细胞外蛋白的双特异性小分子可能诱导胞外蛋白通过溶酶体降解,从而提供了一种通过使用在细胞外空间起作用的结合剂来加速蛋白降解的手段。
主要内容
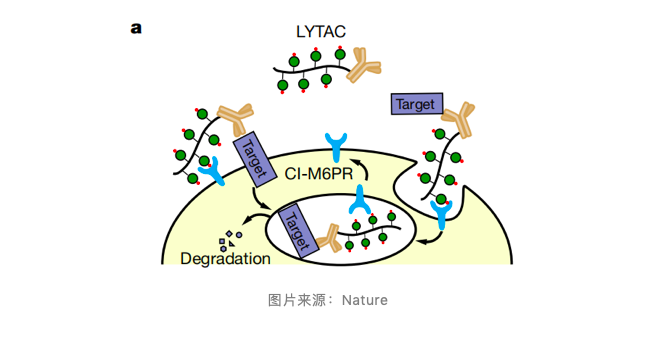
溶酶体靶向受体(LTR)选择的是非阳离子依赖型甘露糖 - 6 - 磷酸受体(CI-M6PR)。溶酶体酶和 M6PR 结合形成的受体配体复合物被转运至前溶酶体,在其中的低 pH 环境里,受体和配体分离,溶酶体酶被转运至溶酶体,而 M6PR 循环回高尔基复合体或质膜。
因此,Cl-M6PR 已经被用于溶酶体储存障碍酶替代疗法的递送。研究把细胞膜上溶酶体靶向受体(LTR)的已知激动剂与抗体或小分子配体链接起来形成 LYTAC,与 LTR 结合后可将分泌蛋白和膜蛋白内吞到溶酶体降解。
研究发现 LYTACs 可以作为研究受体转运和蛋白质降解的生化探针,并且可以介导分泌蛋白和膜蛋白的降解。
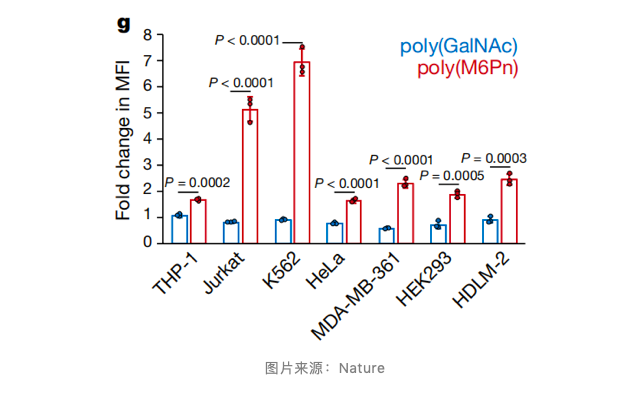
为了开发适合 CI-M6PR 的配体,研究通过化学合成得到了 M6Pn 糖多肽,并实现最佳的 CI-M6PR 激动作用。为了证明 CI-M6PR 驱动的 LYTAC 的可行性,研究设计了一种细胞内测定法来测量生物素 - 中性抗生物素蛋白(NA-647)的摄取。数据表明,LYTACs 在不同细胞系中介导了 NA-647 的摄取,证明了 CI-M6PR 靶向的广度以及小分子负责靶向的准确度。
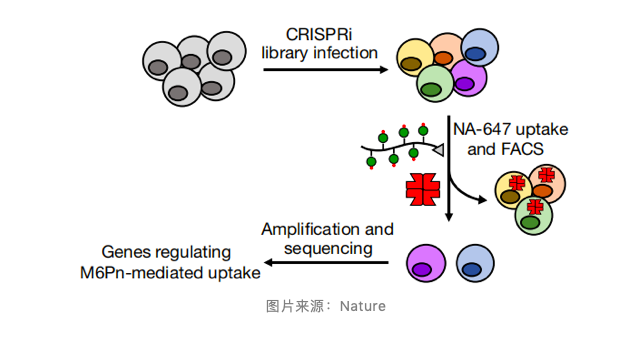
接下来,研究基于 CRISPR 干扰(CRISPRi)的高通量遗传筛选技术,鉴定主要目标基因。通过荧光激活细胞分选(FACS)分离出显示 NA-647 标记显着减少的细胞群,并进行下一代测序以鉴定在该群中过分表达的 sgRNA。数据表明,CI-M6PR 的表面呈递部分地由囊外复合物介导,并且表示 LYTAC 可用于研究调节细胞表面受体的分子途径。
研究还发现,LYTAC 介导的溶酶体中靶标富集与靶标降解有关。更广泛地讲,将溶酶体靶向配体与抗体缀合可以重新编程抗体以指导细胞外抗原降解。
那 LYTAC 到底是否可用于加速细胞外膜结合蛋白的降解?
原则上,这需要同时结合表面相关蛋白和 CI-M6PR。研究首先针对 EGFR(一种已知的癌症增殖驱动因子)进行研究。LYTAC 使用的是结合 M6Pn 的 EGFR 的阻断剂(ctx-M6Pn),研究观察到 EGFR 的实质性降解,而未观察到 CI-M6PR 水平的变化。
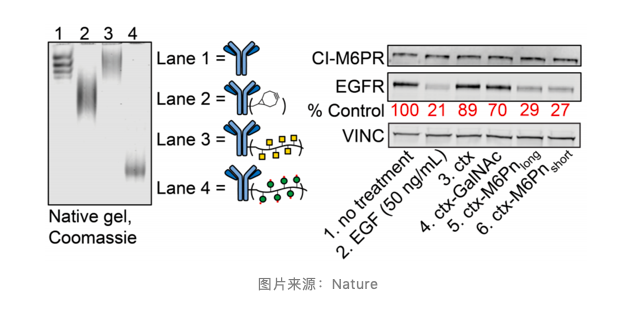
此外,研究还表明对靶标和 CI-M6PR 具有双重亲和力的 LYTAC 可以保持较高的靶标特异性。在乳腺癌和肝细胞癌细胞系中也观察到 EGFR 降解。
接下来,研究使用定量质谱技术对细胞中的 LYTAC 降解特异性进行蛋白质组范围的表征。尽管这些变化的确切机制仍有待阐明,但这些数据表明,LYTAC 可能提供一种手段来监测细胞对目标蛋白质降解的反应。
为了了解 LYTAC 作用的广度,研究将目标扩大到几种其他的膜相关蛋白。例如一种正在向临床试验发展的治疗性癌症靶标 —— 转铁蛋白受体 1(CD71),其可在早期的内体与细胞表面之间循环,从而避免转运至溶酶体进行降解。实验观察到,由于 M6Pn 的识别、LYTAC 作用下的 CD71 发生降解。
此外,研究测试了 LYTAC 对 PD-L1(癌细胞免疫逃逸的驱动力)的降解。为了使 PD-L1 加速降解,LYTAC 必须克服 PD-L1 的再循环途径。研究发现,LYTAC 可以超越细胞表面蛋白的内源性循环程序,并加速其溶酶体降解。
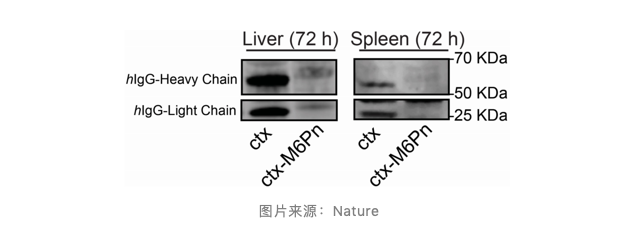
化学合成得到的 M6Pn 配体如何影响体内抗体清除率呢?研究者向 BALB/c 小鼠腹膜内注射 ctx 和 ctx-M6Pn,并通过 Western 印迹法测定血清抗体水平。数据表明了两种清除方式:快速初始清除和较慢,更持久的清除。调节这两种方案对于调整 LYTAC 和靶蛋白的任何单独组合的体内功效至关重要。
总之,LYTAC 可直接靶向胞外和膜相关蛋白进行溶酶体降解。而 LYTAC 的成功靶向是由多种因素共同导致的,这些因素包括内源性蛋白质运输和转换的动力学、溶酶体表面定位的数量、通过网格蛋白介导的胞吞作用的溶酶体的敏感性以及与溶酶体靶向受体相关的化学计量学。
虽然实验中 LYTAC 只是利用了 CI-M6PR,但不局限于该一种 LTR。通过选择其他 LTR,从而带来可降低靶向癌蛋白时产生耐药的可能性。研究也表示小分子和多肽都可以用作 LYTAC 中的蛋白质靶向结合剂。调节药代动力学特性以控制 LYTAC 的靶向清除和化学计量,这对于有效降解膜蛋白仍然是进一步应用的关键挑战。研究最后也提出,通过对 LYTAC 的化学调控和模块化的将能够更好的定向降解分泌蛋白和膜蛋白,这无论是在研究还是用于潜在治疗都具有十分重要的意义。
延伸阅读 ——
层出不穷的新药技术,LYTAC 能否经受时间的考验?
值得一提的是,以 LYTAC 为基础的初创公司 Lycia Therapeutics 刚刚于 6 月 9 日获得了 5000 万美元的融资,已开展 LYTAC 相关的 first-in-class 产品管线!
事实上,LYTAC 并非靶向降解胞外蛋白的首次尝试,PROTAC 的发明人、耶鲁大学的 Crews 博士的团队去年 5 月发表文章 Targeted Protein Internalization and Degradation by ENDosome TArgeting Chimeras (ENDTACs),提出一种新技术 ENDTAC。
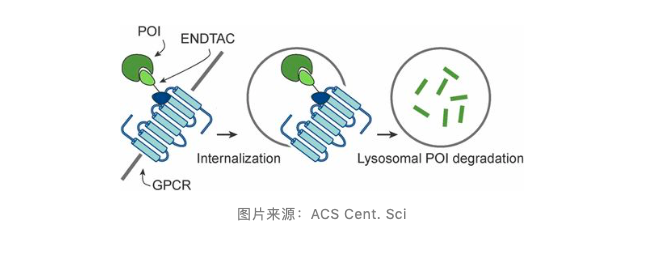
被称为 ENDTAC 的双特异性小分子,它的一端可以与细胞外靶点蛋白结合,另一端能够与细胞表面介导内吞作用的受体相结合,这种分子通过将需要降解的细胞外蛋白与细胞表面的受体连接起来,通过内吞方式进入溶酶体降解。
然而,时隔仅半年,该团队即发现重新合成的化合物无法重复此前的数据,撤回了这篇文章。
从描述上看,这两个技术的出发点和思路极为类似,LYTAC 能否经受住时间的考验,尚需要更多的研究者去探索,我们也希望两位化学生物学家能够快速推动靶向蛋白降解疗法的发展。
目前,该领域还处在研究阶段,还有许多因素亟待研究了解。随着如今技术手段的成熟,细胞降解蛋白的分子机制和调控机制也逐渐清晰,而这些更加深入细致的研究也会让疾病治疗进入一个全新时代。