简介
核酮糖-1,5-二磷酸狡化酶/加氧酶 (Rubisco) 是光合作用的重要调节酶,具有双重作用。一是在 Calvin 循环中催化 CO2 的固定,二是能催化将 O2 加在核酮糖-1,5-二磷酸上。其活性是反映植物叶片生长状态、发育程度以及光合碳同化能力的重要生理指标。在植物衰老或遭受逆境时,酶活性呈下降趋势。本实验了解其在光合作用中的作用,并熟悉 Rubi-sco 活性测定方法。
原理
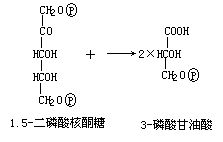
核酮糖-1,5-二磷酸羧化酶/加氧酶活性的测定的基本原理是核酮糖-1,5-二磷酸梭化酶催化 1 分子的核酮糖-1, 5-二磷酸(RuBP) 与 1 分子的 CO2 结合,产生 2 分子的 3-磷酸甘油酸 (PGA),PGA 可通过 3-磷酸甘油酸激酶和甘油醛-3-磷酸脱氢酶的作用,产生甘油醛-3-磷酸,并使 NADH 氧化,其反应如下:
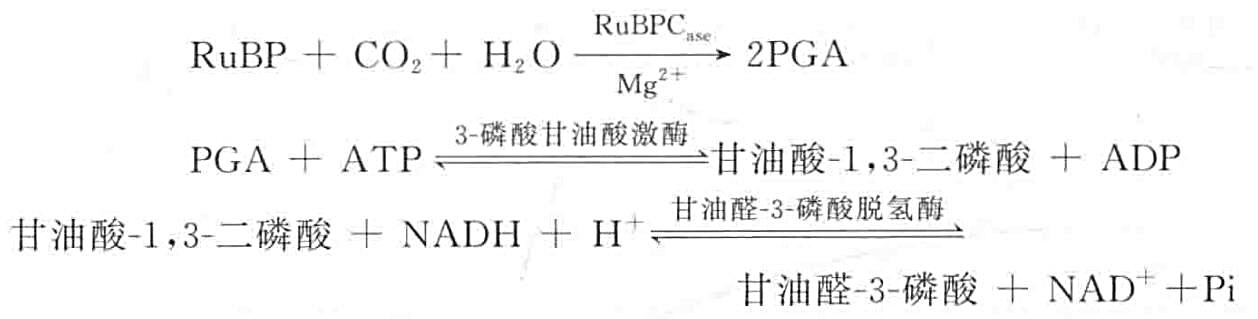
由上式可知 1 分子 CO2 被固定,就有 2 分子 NADH 被氧化。因此,根据 NADH 氧化的量就可计算核酮糖-1,5-二磷酸梭化酶的活性,而由 340 nm 吸光度的变化可计算 NADH 氧化的量。为了使 NADH 的氧化与 CO2 的固定同步,从而需要加入磷酸肌酸(Cr~P)和磷酸肌酸激酶的 ATP 再生系统。

核酮糖-1,5-二磷酸加氧酶催化将 O2 加在核酮糖-1,5-二磷酸 (RuBP)的 C-2 位置上,生 成 1 分子的磷酸乙醇酸和 3-磷酸甘油酸。Rubisco 加氧反应是典型的单加氧反应,将 CO2 的 2 个氧原子掺入 H2O 和磷酸乙醇酸中,因而加氧酶的活性可用氧电极法以氧的消耗来确定。另外,RuBP 在有 MS2+ 离子参与的酶的加氧反应中首先被烯醇化,这时 RuBP 的 C-2 位置被调整为 1 个负碳离子,当与分子氧反应后形成过氧化离子,然后电子又从氧回到烯醇化的 RuBP 再生成负碳离子并产生单线态氧,而这单线态氧可以利用发光光度计来检测。发光光 度计法测定加氧酶活性比氧电极法灵敏度高 70 倍。但如果要测定 Rubisco 的加氧活性的绝对值,则要用氧电极法先行标定。
材料与仪器
材料:菠菜、小麦及水稻等植物叶片。
试剂:
5 mmol・L-1 NADH;25 mmol・L-1 RuBP;0.2 mol・L-1 NaHCO3。
提取介质:40 mmol・L-1 Tris-HCl 缓冲液(pH 7. 6),内含 10 mmol・L-1 MgCl2 0.25 mmol・L-1 EDTA、5 mmol・L-1 谷胱甘肽。
反应介质:100 mmol・L-1 Tris-HCl 缓冲液(pH 7. 8),内含 12 mmol・L-1 MgCl2 和 0.4 mmol・L-1 EDTA-Na2;160 U・mL-1 磷酸肌酸激酶溶液;160U・mL-1 油醛-3-酸脱氢酶溶液;50 mmol・L-1 ATP;50 mmol・L-1 磷酸肌酸;160 U・mL-1 磷酸甘油酸激酶溶液。
提取缓冲液:100 mmol・L-1 Tris-HCl(pH7.8);1 mmol・L-1 EDTA;20 mmol・L-1 KC1。
重悬缓冲液:25 mmol・L-1 Tris-HCl(pH7.8);1 mmol・L-1 EDTA;5 mmol・L-1 疏基乙醇;20 mmol・L-1 KCl。
氧电极法反应液:100 mmol・L-1 Tris-HCl(pH8.2);0.4 mmol・L-1 EDTA ;20 mmol・L-1 MgCl2。
发光光度计法反应液:50 mmol・L-1 Tris-HCl(pH8.0);1.0 mmol・L-1 MnCl2 ; 1.0 mmol・L-1 NaHCO3。
亚硫酸钠;0.1 mmol・L-1 二硫苏糖醇(DTT);硫酸铉;NaCI;10 mmol・L-1 RuBP 储存液(pH6.5)。
器材:
① 紫外分光光度计
② 冷冻离心机
③ 组织捣碎机
④ 移液管
⑤ 秒表
⑥ 氧电极测氧装置
⑦ FG-300 型发光光度计
步骤
核酮糖-1,5-二磷酸羧化酶/加氧酶活性的测定的基本过程可分为如下几步:
(一)核酮糖-1,5-二磷酸梭化酶/加氧酶裁化活性的测定
1. 酶粗提液的制备:取新鲜菠菜叶片 10 g,洗净擦干,放匀浆器中,加入 10 mL 预冷的提取介质,高速匀浆 30 s,停 30 s,交替进行 3 次;匀浆经 4 层纱布过滤,滤液于 20 000 g 4 ℃ 下离心 15 min,弃沉淀;上清液即酶粗提液,置 0 ℃ 保存备用。
2. RuBPCase 活力测定:按表 15-1 配制酶反应体系。
|
试剂 |
加人量 |
试剂 |
加入量 |
|
5 mmol・ml-1 NADH |
0.2 |
反应介质 |
1.4 |
|
50 mmol・ml-1 ATP |
0.3 |
160 U・ml-1 磷酸肌酸激酶 |
0.1 |
|
提取介质 |
0.1 |
160 U・ml-1 磷酸甘油酸激酶 |
0.1 |
|
50 mmol・ml-1 磷酸肌酸 |
0.2 |
160 U・ml-1 甘油醛-3-磷酸脱氢酶 |
0.1 |
|
0.2 mol・ml-1 NaHCO3 |
0.2 |
蒸馏水 |
0.3 |
3. 将配制好的反应体系摇匀,倒入比色杯内,以蒸憎水为空白,在紫外分光光度计上 340 nm 处反应体系的吸光度作为零点值。将 0. 1 mL RuBP 加入比色杯内,并马上计时,每隔 30 s 测 1 次吸光度,共测 3 min。以零点到第一分钟内吸光度下降的绝对值计算酶活力。
由于酶提取介质中可能存在 PGA,会使酶活力测定产生误差,因此除上述测定外,还需
做一个不加 RuBP 的对照。对照的反应体系与上述酶反应体系完全相同,不同之处只是把酶提取介质放在最后添加,添加后马上测定此反应体系在 340 nm 处的吸光度,并记录前一分钟内吸光度的变化量,计算酶活力时应减去这一变化量。
4. 结果计算

式中:∆A—反应最初 1 min 内 340 nm 处吸光度变化的绝对值(减去对照液最初 1 min 的变化量);
N一稀释倍数;
6.22—每微摩尔 NADH 在 340 nm 处的吸光系数;
2—表示每固定 1 mol CO2 有 2 mol NADH 被氧化;
∆t—测定时间 1 min;
d—比色皿光程,cm。
(二)核酮糖-1,5-二磷酸狡化酶/加氧酶加氧活性的测定
1.Rubisco 的提取及纯化:取 5~7 g 叶片加入 10 mL 预冷到 4 ℃ 的提取缓冲液,匀浆, 15 000 g 离心 10 min,取上清液备用。
将上述得到的粗提液用 40% 饱和度的硫酸铉进行分步沉淀,冷冻离心 20 min(4 ℃, 8 000 g)。然后取上清液,加 70% 的饱和度硫酸铉,冷冻离心 20 min(4 ℃,10 000 g)后取沉淀,用少量重悬缓冲液溶解,再经 Sephadex G-25 脱盐后上 DEAE(DE 52)柱,用含 0.0~0.5 mmol・ml-1 NaCl 的重悬缓冲液进行梯度洗脱,分步收集 0.20~0.25 mmol・ml-1 NaCl。70% 硫酸铉沉淀,于一 20 ℃ 保存,待测活性前以 8 mg・ml-1 溶于重悬缓冲液中备用。
2. 氧电极测定法测定 Rubisco 加氧酶活力:将 2 mL 氧电极法反应液,在大气中搅拌 10 min, 使溶液中的溶解氧与大气平衡。然后把电极放在反应室上,调节测氧仪的灵敏度旋钮,使记录仪至满刻度,再加入 0.1 mL 饱和的亚硫酸钠,除尽水中的氧,指针退回到接近 0 点,根据指针退回的格数和 25 ℃ 水的溶解氧量,就可以计算出每格记录纸所代表的溶氧量。 25 ℃ 时的水溶氧量为 0.26 μmol・mL-1。每格记录纸代表的溶氧量计算如下:

将 2 mL 空气饱和的溶液加入反应室,加入 0.1 mL 酶液(8 mg・ml-1),在 25 ℃ 保温 10 min 后,装好电极,记录由 DTT 氧化所消耗氧的空白速度,最后加入 0.01 mL RuBP 储存液开始反应,记录反应速度,反应速度以每分钟多少格子记录纸来表示。加氧酶的活力就可通过以下公式计算:

3. 发光光度计法测定 Rubisco 加氧酶活力:先在比色杯中加入 25 μL RuBP 储存液,放入发光光度计反应暗室中,然后将 1.4 mL 发光光度计法反应液中加有 10 μL 酶液的混合液在 25 ℃ 保温 10 min,然后注入比色杯开始反应,自动记录发光曲线。发光强度以峰高来表示(mm)。
注意事项
1. 提取Rubisco应在冰浴条件下进行。
2. RuBP很不稳定,特别在碱性环境下,因而应在pH5.0-6.5之间于 - 20 ℃ 保存,最好现配现用。
来源:丁香实验