简介
植物组织培养可以在不受植物体其他部分干扰下研究被培养部分的生长和分化的规律,并且可以利用各种条件来影响它们的生长和分化,以解决理论和生产上的问题。
同时,组织培养作为生物工程的一项重要技术,在基础理论和应用研究以及生产实践中发挥着巨大的作用,并具有广阔的应用前景。通过本实验主要了解植物激素对外植体生长和分化的影响,并通过实验练习来掌握组织培养的基本技术。
原理
愈伤组织分化根和芽受培养基中生长素和细胞分裂素的相对浓度的影响,生长素/细胞分裂素比值高时,促进根的分化;比值低时,则促进芽的分化;两种激素比值适中时, 则愈伤组织生长占优势或不分化。这样,通过改变两种激素的相对浓度即可有效地调节愈伤组织再分化的进程。
材料与仪器
步骤
植物激素对愈伤组织形成和分化的影响的基本过程可分为如下几步:
(一)按MS培养基配方(见附录七),先配制各母液:
1 .按表23-1,配制10倍的大量元素母液:

2.按表23-2配制100倍的微量元素母液:
3. 200倍的铁盐母液:称EDTA-Na2 3.37 g,FeSO4 · 7H2O 2.78 g,用蒸憶水溶解并定容至 500 mL。
4. 有机成分:
20 mg · mL-1的肌醇溶液:称取2 g肌醇,用蒸馋水溶解后定容至100 mL。
5 mg · mL -1的烟酸溶液:称取12.5 mg的烟酸,用蒸馆水溶解后定容至25 mL。
1 mg · ml-1的甘氨酸溶液:称取25 mg甘氨酸,用蒸憶水溶解后定容至25 mL。
5 mg · mL-1的盐酸毗哆醇(维生素B&):称取12.5 mg盐酸毗哆醇,用蒸儒水溶解 后定容至25 mL。
1 mg · mL-1的盐酸硫胺素(维生素BQ:称取10 mg盐酸硫胺素,用蒸偕水溶解后定容至100 mL。
5. 植物激素:
1 mg · mL-1的蔡乙酸溶液:称取10 mg NAA,用少量95% 乙醇溶解后,用蒸储水定容至100 mL。
1 mg · ml-16-节基腺噤吟:称取50 mg 6-BA,用少量1 mol・L-1的HCL溶解后,用蒸馋水定容至50 mL。
(二)配制培养基
1. 将各种元素的母液混合.配制成MS培养基,1 L MS培养基中各种元素的母液含量如 表23-3所示:

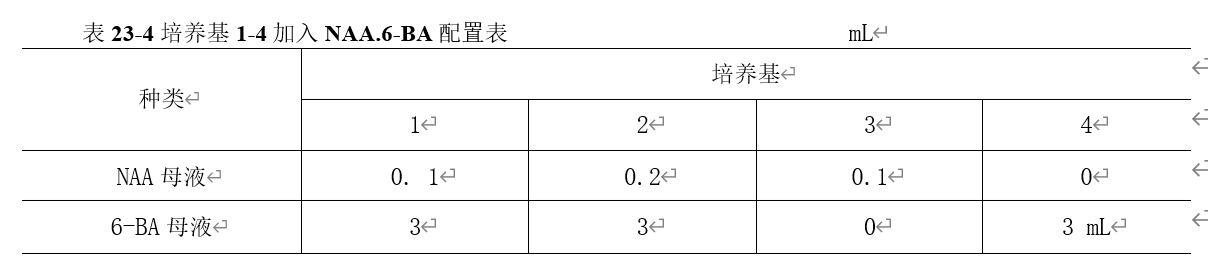
2. 再按表23-4分别加入NAA和6-BA母液:
 |
||||
1. 先在三角烧杯(或不锈钢锅)中加入600 mL蒸馋水,加入相应量的琼脂和蔗糖,在水浴 锅里将琼脂溶化,如果直接加热应不停地搅拌,防止瓶底(或锅底)烧焦或沸腾溢出。再将上 述各种物质母液混合其中,混匀,用1 mol - L 1 NaOH溶液或1 mol - L 1 HCL溶液调pH 至 8,用蒸儒水定容至1 L。
将培养基分注到三角瓶或试管中,按容器的大小和培养要求放入适当量的培养基。分装时注意不要把培养基沾附到瓶口或管口附近的内壁上,以免培养过 程中发生污染。分装中还要不时搅动下口杯中的培养基,否则先后分装的各瓶培养基凝固能 力不同。盖上棉塞,用牛皮纸包扎好后,放入高压灭菌锅,121 °C下灭菌20 min,冷却后备用。
(三) 材料的灭菌与接种
取开花前2~3天已露白的菊花花蕾,先用自来水冲洗花蕾,然后在75% 乙醇中浸泡15 s,后用无菌水冲洗2次,再用1% 次氯酸钠溶液浸泡15 min,并不时轻轻搅动。用无菌水 清洗3次,再转入放有滤纸而又无菌的培养皿中,用剪刀剪取舌状花,用解剖刀将舌状花切为 5 mm×5 mm大小的小块,一个100 mL的三角瓶中6~8个小块。将接种后的舌状花块放 到培养室中培养。培养室内的温度为(25士2)笆,日光灯每天照明12 h,光照强度约2000 lx。
(四) 结果观察和记录
接种后注意观察记录外植体上愈伤组织和根芽岀现的时间和数量,加以分析比较。
注意事项
1. 在配制植物激素时,溶解试剂的乙醇和盐酸用量要少,用蒸储水稀释时,慢慢沿烧杯内 壁加入。
2. 对培养基和材料及接种过程中所用器具都要严格灭菌。
3. 分装培养基时,不能把培养基沾附到瓶口上,以免引起污染。
4. 在温室内培养过程中,经常检查,及时剔除污染的材料或三角瓶。
来源:丁香实验







