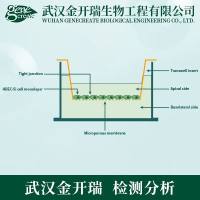
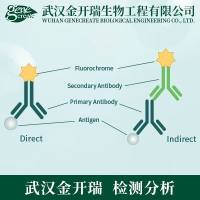
材料与仪器
步骤
一、培 养 基 及 试 剂 配 制 细 则
1. 性 腺 细 胞 解 离 培 养 基(C D M )
(i ) Hank’s 平衡盐溶液(HBSS)
(ii) IV 胶原酶, 2. 5 mg/ml
(iii) DNase I , 20U/ml
(iv) 热灭活的新生牛血清, 2 % V/V
(v) CaCl2, 0 •54 mmol/L (60ug/ml)
2.饲 养 层 细 胞 培 养 基(F C M )
(i) D M E M
(ii) 胎 牛 血 清(FBS), 2 % V/V
(iii) 青霉素, lOOU/ml
(iv) 链霉素, 100ug/ml
3. 生 殖 细 胞 培 养 基(G C M )
去血清 D M E M 含有:
(i) 去 血 清 替 代 物(KO-SR) , 或 E S C 测 试 胎 牛 血 清(ESC-FBS) …… 1 5 % V/V
(ii) L-谷 氨 酰 胺 ……………………….. lmmol/L
(iii) 2-疏 基 乙 醇 ……………………. 0. lmmol/1
(iv) 非必需氨基酸IOOX ………………………1%v/v
(V) 青 霉素 …………………………..100U/ml

二、细 胞 培 养 方 法 学
所有培养都是在 5 % C 0 2、 9 5 % 湿度、 37°C 条件下进行,操 作 在 层 流 罩 内 进 行( II级微生物安全柜),我 们 用 7 5 % 乙醇清洁表面、管道和器具,所有细胞培养塑料器皿都是无菌的 。
1. 饲 养 层 细 胞 培 养
多种类型的小鼠、人胚胎细胞已被证实具有支持 P G C s 生长、促 进 h E G C s 衍生的作用。然而在实验中,我 们 还 是 发 现 了 一 种 饲 养 细 胞 系 S T O 成纤维细胞具有显著的促进作用,其 他 学 者 也 有 同 样 的 发 现 [Shamblott etal., 1998; 2004]。 下列方案就
是使用这种细胞。 S T O 是永生化的 S I M (Sandoz Inbred mice) 胚胎成纤维细胞系,这种细胞可以表达鼠科动物细胞膜结合的干细胞生长因子,在体内及体外这种因子都是生殖细胞的鉴别性因子 [ T u r n p e n n y e t a L , 2006]。然 而 ,与任何一种无限细胞系一样,STO细胞的特性随着培养时间的延长,亚系之间会发生变化。因此,为了保持一致从一个冷冻管来源的细胞经过有限次数的传代之后,最好要制备一批生长停滞的细胞冻存物保存起来。这样的细胞来源也可从供应商获得,例 如 A T C C _ L G C Promochen 合资企业或欧洲细胞培养物保藏中心(ECACC)。如果出现对 PGCs 生长的支持作用下降,这批细胞就应该放弃,重新制备新的细胞。
方 案 1 饲 养 层 细 胞 的 制 备 及 培 养
试剂与材料
无菌的或无菌制备
□ STO 成纤维细胞(ATCC CRL 1503; ECACC)
□饲养层细胞培养基(F C M ; 见 5. 2. 2 节)
□饲养层细胞冻存培养基
□ PBSA
□胰蛋白酶, 0.25%, E D T A , lmmol/L ,溶解于 PBSA
□培养瓶, 75 cm2 或 150 cm2
□无菌的锥底离心管, 15 ml 或 50 ml
步骤
(a) 从液氮罐中复苏一管 S T O 成纤维细胞,局部浸泡在 37° c 水浴中促进其快速溶解。
(b) 当 90 % 细胞悬液溶解时,将冷冻管转移至细胞培养超净台内,用 7 5 % 乙醇清洁冷冻管的表面。
(c) 在管中加人预温的 F C M ,将细胞悬液转移至一个 15mi 离心管中,内含 6m i 预温 的 F C M 。
(d) 250 g离心 3 min
(e) 弃上清,用 预温的 F C M 重悬细胞团,转 移 至 一 个 细 胞 培 养 瓶(培养体积:10 ml/75 cm2 或 20 ml/150 cm2 , 放人培养饲养细胞的温箱中。
(f) 定期更换培养基(每两天)。
(g) 当细胞生长至汇合或接近汇合时,吸去培养基,用预温的无菌 P B S A 轻缓清洗。
(h) 传代时将预温的胰蛋白酶-E D T A 加人培养瓶内使细胞脱落, 75 cm2 的培养瓶加 3 ml, 150 cm2 的培养瓶加 6 ml,保证整个培养面都被覆盖。不时地轻叩培养瓶,大约3 min 后可见细胞层从瓶壁上脱落(此过程不必将培养瓶放回培养箱中)。
(i) 加人预温的 FCM (每 Iml 胰蛋白酶对应加人 3ml FCM ) 终止胰蛋白酶的活性,用吸管反复轻轻吹打使残留贴附的细胞脱落下来。
(j) 将细胞悬液转移至无菌的 15m l 或 50m l 离心管中, 250 g 离 心 3 min 使细胞沉降。
(k) 用 IOml 温 FC M 重悬细胞沉淀, 1 : 5 稀释重新接种。
(l) 重复传代步骤,一 次 应 该 得 到 大 约 20〜 3 0 瓶(75c m 2) 汇 合 的 S T O 成纤堆细胞。
2.阻断饲养 层 细 胞 的 生 长
用丝裂霉素 C 处理或用离子射线照射均可使细胞停止生长。我 们 在 使 用 γ 射线方面取得了较好的经验。我们的实验方案比较辛苦,需要预先计划,具备使用相应仪器设备的条件。然而,可 以 制 备 多 份 备 用 细 胞 冻 存 起 来(每 75c m 2 的培养瓶长满后冻存一管),这样就可保证获得均一的单层细胞,而不需要持续不断地制备、细 胞 计 数(如果
采用丝裂霉素 C 处理,就必须计数)。方 案2 中的细胞数量是有意调高的,因为在照射及细胞冻融过程中细胞的死亡不可避免。总之,根据我们的经验,此方案节省时间、节省耗材,又可提供稳定的单层 S T O 成纤维词养细胞。
方 案 2 饲养层细胞的生长阻断
试剂与材料
无菌的
□ 生 长 中 的 S T O 成 纤 维 细 胞(见 方 案 5. 1)
□ 饲 养 层 细 胞 培 养 基(F C M ; 见 5. 2. 2 节)
□ 饲 养 层 细 胞 冻 存 培 养 基(F F D M ; 见 5. 2. 4 节)
□ P B S A
□ 胰 蛋 白 酶 , 0.25%, E D T A , l m m o l /L , 溶解于 P B S A
□ 培 养 瓶 , 75c m 2 或 150c m 2
□锥底离心管, 50m l , 无菌
□冷冻管
□ γ射 线 源(例如 137C s )
□ 含 有 250m l 异丙醇的可控速率冷冻容器
步骤
(a) 必须在细胞生长至汇合时(每个75cm2培养瓶约有 8 X 106 个细胞)进行辐射处理 ,我们的经验是:过了这个点最好就不要进行细胞的处理。
(b ) 照射前的晚上更换培养基。
(c) 吸去培养基,用预温的无菌 P B S A 轻轻清洗细胞。
(d) 将预温的胰蛋白酶-E D T A 加人培养瓶内使细胞脱落, 75c m 2 的 培 养 瓶 加 3m l ,150c m 2 的培养瓶加 6m l , 保证整个培养面都被覆盖。不时地轻叩培养瓶,大 约 3 m i n 后可见细胞层从瓶壁上脱落(此过程不必将培养瓶放回培养箱中)。
(e) 加 人 预 温 的 F C M ( 每 I m l 胰 蛋 白 酶 对 应 加 人 3m l F C M ) 终止胰蛋白酶的活性 ,用吸管反复轻轻吹打使残留贴附的细胞脱落下来。
(f) 将细胞悬液转移至无菌的 50m l 离 心 管 中(为了便于操作,每管内的液体体积最好不要超过 30 ml), 250g离心 3 min 使细胞沉降。
(g) 用 IOrnl 温 FC M 重悬细胞沉淀,将离心管密封。
(h) 用 50 G y 的 γ射线照射,使重悬的 ST O 细胞失去有丝分裂活性(我们使用的是 37-MBq137C s 放射源照射 23 min 达到此剂量),此剂量适合于处于这种质量及密度的STO 细胞,不同的细胞系或不同的细胞数量可能需要调整照射的时间。
(i) 250 g 离 心 3 min 使细胞沉降。
(j) 用预温的 FFD M 充分重悬细胞,每 个 75 cm2 培养瓶培养的细胞用 l m l 的冻存液。
(k) 保持均匀的细胞悬液,按 1mI 的量分装至各冷冻管中,放在可控速率冷冻容器内置于一 80°C 过夜。
(l) 次日晨,将冷冻管转移至液氮罐中。
三、 接种单层饲养层细胞
为了进行实验室研究,要获得具备一定质量并且处于特殊时间段内的人体临床材料 ,而使用人体临床材料往往不能像使用动物模型那样可预先计划。最好是在开始进行人生殖细胞培养的前一天接种阻断生长的单层成纤维细胞饲养层,但如果再早一天接种 ,饲养细胞仍然可用。当临时得到实验材料进行取材时,我们发现饲养细胞可以在5 h 内成功地附着在培养表面,这其中一部分原因是由于接种饲养细胞的培养基与接种生殖细胞的培养基不同: FCM 含有血清,血清中含有促进细胞黏附于培养器皿表面的因子,而 GCM 中的去除血清替代物(KO-SR , 见 5.7 节)不含这些「黏附因子」。
建立生殖细胞培养常有一些不能确定的因素(见 5. 3.4 节),细胞开始明显生长可能需要一周以上的时间,而饲养层细胞能够存活的平均时间大约为 1 0 天,这就是为什么在进行生殖细胞培养前预先接种饲养层细胞不能超过两天。还有,在组织取材的当天早晨将 FCM 转换成 GCM, 这段时间可以使 GCM 被饲养层细胞释放的因子所同化。
方案 5. 2 中提到,经过辐射处理的饲养细胞在冷冻时是按照每个 75 cm2 的培养瓶长满汇合时的细胞冻存一管的比例进行,这个细胞数量能够接种的表面积大约相当于一个直 径 IOcm 的培养皿。因此一个冷冻管所含的细胞足以在一个直径 IOcrn 的培养皿中形成单层,或按比例计算,可以接种 3〜4 个 直 径 6 cm 的培养皿, 8 个直径 3. 5 cm 的培养皿 ,或一个 6 孔板, 1 ¾ 个 12 孔板, 1.5 个 2 4 孔板。同样也可推论至 96 孔板或纤连蛋白预包被的玻片(方案 5.4)。
方 案 3 接 种 生 长 阻 断 的 单 层 饲 养 细 胞
试剂与材料
无菌的或无菌制备
□无分裂活性的 S T O 成纤维细胞(见方案 5. 2)
□词养层细胞培养基(F C M ; 见 5, 2, 2 节)
□生殖细胞培养基(GCM; 见 5. 2. 3 节)
□ PBSA
□ 胰 蛋 白 酶 , 0 . 2 5 % , lmmol/L ED T A , 溶解于 PBSA
□ 培 养 器 皿(直径 6 或 3_ 5 cm 的培养皿或 24、 12、 6 孔培养板)
□ 锥 底 离 心 管 , 15 ml
步骤
(a) 开始进行生殖细胞培养的前一天,从液氮罐中取出一管经辐射处理过的 STO成纤维细胞,局部浸泡在 37°C 水浴中促进其快速溶解。
(b) 当 9 0 % 的冷冻物溶解时,将冷冻管转移至细胞培养超净台内,用 75% 乙醇清洁冷冻管的表面。
(c) 将细胞悬液转移至一个 15m l 离心管中,内含 6m l 预温的 FCM ,短暂轻轻吹打混勻, 250 g离心 3m i n 。
(d) 用 F C M 重悬细胞,加人的体积为总培养体积的一半;将另一半体积的培养基加至培养皿或培养孔中;将重悬的饲养细胞按比例平均地加至培养皿或培养孔中。小心地将这些培养器皿放在细胞培养箱中。
(e) 次 日 晨( 即取组织的当天), 吸 去 FCM ,用无菌 P B SA 轻轻清洗细胞。
(f) 去除 PBSA , 轻轻加入预温的 GCM, 达到生殖细胞总培养体积的一半(见方案 5.5)。
(g) 将培养器皿放回培养箱中,直至接种生殖细胞。
我们在塑料组织培养器皿中接种经射线照射过的成纤维细胞饲养层,随后接种人的性腺细胞,同时也可制备用于细胞培养的玻片而后接种细胞,带小室的玻璃培养片适合于随后要进行荧光免疫细胞化学分析细胞类型的实验(方 案 5. 8)。为了使成纤维细胞有效地贴附,玻片在使用前要用一些细胞外基质的模拟物包被一下。我们发现纤连蛋白是最便宜的,又是最可靠的促贴壁因子,尽管它的原理与其他试剂如层粘连蛋白(laminin) 或Matrigel 没有什么区别。与此类似,也可用明胶包被的培养皿进行 E G C 分化的研究。
方 案 4 包 被 带 培 养 小 室 的 玻 片 或 组 织 培 养 皿
试剂与材料
无菌的
□ 明 胶 , 2 % 无菌溶液
□ 纤 连 蛋 白(牛; l m g / U)
□带小室的玻片
步骤
(a) 在细胞培养超净台中将带小室的玻片从无菌包装中取出。
(b ) 吸取纤连蛋白放在每个小室的中央, 5ug/cm 2,将吸管中的空气排出形成一个气 泡 ,以此将纤连蛋白涂开覆盖整个孔的表面。
(c) 将带小室的玻片盖好,放人组织培养超净台中干燥,根据我们的经验,制备好的玻片至少可以在 4°C 存放一周。
(d) 如果要用明胶包被培养皿,可将用无菌水配制的0.1% 的明胶工作液涂在培养皿的表面,放 置 I h , 而后吸去液体,将盖子留个小缝,将培养皿放在组织培养超净台中干燥。明胶包被的培养皿至少可以在 4°C 存放一个月。
四、 人 胚 胎 性 腺 细 胞 的 原 代 培 养
在英国,使用人胚胎及胎儿材料要执行 PoIkinghorne 委 员 会 在 1989 年制定的操作指 南 法 规 [PoIkinghorne, 1989]。此 外 ,研 究 项 目 需 要 通 过 伦 理 认 可 ,只有与那些准备 在 妊 娠 的 社 会(或自愿)终止期流产的妇女签署了知情同意书之后方可取材。
我们的实验已从大约受孕后 7〜11 周(w p c ) 的胚胎取出生殖嵴,在解剖镜下用无菌的器械和容器鉴别及解刮。这种操作能使随后的污染风险降至最低。但一定要认识到经阴道获得的材料并非无菌,因此我们要使用专用的培养箱,将人生殖细胞原代培养与其他所有的培养分开。
分离出的生殖嵴放在无菌的 H B S S 中,转移至超净台内进行细胞分离。我们介绍两种解离方法,这两种方法都是可变化的,大概有一些不可控制的因素,包括 :材料所处的不同发育阶段;取材与开始操作之间的时间;可供操作的样品数。最终得到的细胞悬液将含有单个细胞、小的细胞团以及大的未解离的细胞块,细胞块会沉降,用吸管将单个细胞和小的细胞团吸出用于接种。尽管第一种方法可能得到较多的细胞,但使用了蛋白酶使一定比例的细胞溶解,对细胞表面的重要蛋白产生潜在的损伤。与此相反,第二种方法可能得到的细胞数较少,但避免了长时间的清洗、重悬,将潜在的损伤减少到最小。我们发现这两种方法都可有效地应用于最初的 h E G C 培 养 ,然而到目前为止我们还是不能够确定哪一种方法的产量更高。同样,我们也已确定从生殖嵴中保留或去除中肾得到的培养物没有什么差别。
我们的生殖细胞培养基列于 5. 2. 3 节 ,在我们看来,还不清楚的问题是,在建立和维持生殖细胞培养过程中,添 加 forskolin、重 组 人 成 纤 维 细 胞 生 长 因 子 2 (F G F -2)、重组人白血病抑制因子(L I F ) 是否有明显的不同。已发表的有关 h E G C 培养的文献,也包括我们的文章,都 添 加 f 这 搜 因 子 [Shamblott et al., 1998; T u r n p e n n y et a L ,2003; L i u e t a L , 2004: P a r k e t a l ., 2004]
方 案 5 人 胚 胎 性 腺 的 解 剖 解 离 及 细 胞 接 种
试剂与材料
灭菌的或无菌制备的
□ 预 接 种 的 生 长 阻 断 的 S T O 成 纤 维 细 胞(见 方 案 5. 3)
□ 生 殖 细 胞 培 养 基(G C M ; 见 5. 2. 3 节)
□ H an kS 平衡盐溶液(HBSS)
□ EDTA, 二钠盐, 0.3 mmol/L (0.01%), 溶于 PBSA
□细胞解离培养基(CDM, 见 5. 2. 1 节)
□锥底离心管, 15 ml
□手术刀
□ 针 头 , 18 G
□用于解剖的玻璃培养皿或玻片
□ 尼 龙 网 , IOOum 孔径,根据培养器皿的大小剪裁,高温高压灭菌。
非无菌的
□ 摇 床 ,温度设置在 37°C ,速度大约为 200r/m i n 。
步骤
(a) 解 剖 出 性 腺(含或不含中肾),置于无菌的 H B S S (见阁 5.2 )

(b) 任选下列一种方法制备细胞用于接种。
程 序 1
① 将组织浸泡于 EDTA 溶 液 IO m in , 而 后 放 回 HBSS 中。
② 在一个无菌的玻璃培养皿(或玻片)上 ,用无菌的手术刀和镊子将组织以机械法解离,组织要保持在少量 HBSS 中,避免干涸。
③ 将 材 料 转 移 至 15m l 锥 底 离 心 管 中 ,内 含 2m l 细 胞 解 离 液(C D M ) , 在摇床上37°C 摇 1〜2 h , 用 带 有 18 G 针头的注射器随机研磨。
④ 250 g 离 心 , 3m i n 。
⑤ 小心吸弃上清,随意清洗。如果不做这一步,第四步离心后得到的沉淀可以直接重 悬(步 骤 7)。
⑥ 加 入 3m l H B S S ,用吸管吹打,轻缓地重悬细胞团,而后再次 25 叹 离 心 , 3 min,小心吸弃上清。
⑦ 用 预 温 的 G C M 重 悬 细 胞 团(体积为总培养体积的一半,参 考 方 案 5.3 ,步骤7),放 置 3〜5m i n 。
程 序 2
①将组织浸泡于 ED TA 溶 液 2 0 m in , 而 后 放 回 HBSS 中。
② 将组织放入一个无菌的玻璃培养皿内,加少量预温的 G C M 。
③ 在解剖镜下用无菌的解剖针和镊子刺破挤压整个器官,使细胞直接释放到培养基中。
④ 将培养基转移至一个 15ml尖底离心管中,内含有预温的 G C M [保持整个培养体积的一半,可参考前述方案 5. 3 中 的 步 骤(f) ] , 将细胞悬液放置 3〜5m i n 。
(c) 用吸管收集上清中的单个细胞或小的成团的细胞来接种,或者也可选择用无菌的 、孔 径 IOOum 的尼龙网过滤细胞悬液(将网的下面浸人培养基中湿润,将悬液加在网的上面)。
(d ) 轻缓地将细胞从一边到另一边递次地分配至选好的皿或多孔板中,这些皿或板都预先接种了饲养层细胞,用吸管将细胞直接加至培养基中。
(e) 将培养器皿放人一个专用的 CO2 温箱中。
5.性腺来源细胞培养物的维持
我们的经验是在所有分离性腺来源细胞的原代培养中都要加抗生素,至少是在使用非无菌来源的初始材料时应该使用,但没有必要使用抗真菌的试剂。然而支原体的感染随时存在,因此初始培养与维持培养都要放在一个专用的培养箱中。一旦培养建立,就要进行支原体的常规检测,作为证据,同时还要进行 核 型 特 性 分 析(见 方 案 5.9)。我们采用过多种商品化的可行方法,没有什么特别的改进。
方案6 性腺细胞培养物的维持与传代
试剂与材料
无菌材料
□ 生 殖 细 胞 培 养 基(G C M ; 见 5. 2. 3 节)
□ 无 菌 的 P B S A
□ 胰 蛋 白 酶 ,0.25%, E D T A , l m m o l /L ,溶于 P B S A
□预接种的不分裂的 S T O 成 纤 维 细 胞(见 方 案 5. 3)
□ 饲 养 层 细 胞 培 养 基(F C M ,见 5. 2.3 节)
□ 细 胞 培 养 瓶(直 径 或 3c m 的培养皿或 24、 12、 6 孔板)
□锥底 离 心 管 ,
步骤
(a) 培养的第 3 天 ,从温箱中取出培养物,根据培养基的混浊程度决定采用下列方案中的一种。
(i) 如果培养物已经污染死亡,将其丢弃。
(ii) 如果培养基混浊是由于存在大量死细胞残渣,将培养基全部更换。
(iii) 如果培养基适度清澈,更换一半培养基。
(b ) 小心吸去培养基(完全或部分),轻轻地加入新鲜的预温的 G C M 。
(c) 此后每天重复步骤(a) 和(b )。
(d ) 培养的第 2 周 ,鉴 定 评 价 培 养 物(见 方 案 5.4),将所选择的培养物按以下步骤进行第一次传代。
(e) 小心地吸去培养基,用预温的无菌的 P B S A 轻轻清洗细胞。
(f) 加入最小体积的、预温的胰蛋白酶-ED TA , 只 要 覆 盖 细 胞 生 长 表 面 即 可(如 ,直 径 6 cm 的培养皿加 I m l) ,将培养器皿放回温箱。
(g) 大 约 3m i n 后 ,将培养皿放在显微镜下观察,看细胞是否脱离瓶壁,一 旦细胞开始脱落,就不要长时间地将细胞浸泡在胰蛋白酶溶液中。
(h) 加 人 5m l 预温的 G C M 至培养器皿中,使胰蛋白酶失活,轻轻吹打收集残留的贴壁细胞,如果需要,可以用吸头或无菌的细胞刮轻轻刮取贴壁较牢固的集落。如果只使用了少量胰蛋白酶,也可选择这样操作:加 人 G C M 使胰蛋白酶失活,体积为随后需要使用的培养基总量的一半,而不是前述的 5m l , 这样操作后就进人步骤(1)。
(i) 将 细 胞 转 移(尽量收集)至 15m l 锥底离心管中。
(j) 250 g离心 3m i n , 吸弃上清。
(k) 用随后需要使用的培养基总量的一半,将细胞团轻轻地重新悬浮起来。
(l) 从温箱中取出预接种了饲养细胞的培养器皿,轻轻将细胞放人选择好的培养皿或 培 养 板 中(要逐滴加人,这样可尽量避免损伤细胞),要避免损伤饲养细胞层,将培养器皿放回培养箱中。
(m) 下次传代再从步骤(a) 开始操作。
四、4 培 养 物 鉴 定 与 特 性 分 析
1.区分生殖细胞培养物的状态
在我们的实验以及其他学者的实验中,人生殖细胞培养面临的主要障碍之一是很难在光学显微镜下通过观察集落的形态来可靠地评价培养物的状态(图 5 . 2 , 彩 图 5),尽管集落可见,但不是所有都位于词养细胞的上层,有些是在成纤维细胞之间的空间形成巢状,此处可能有经辐射处理后的细胞所分泌的细胞外基质。另一方面,只有固定及测试之后才能确认组成集落的细胞是否为碱性磷酸酶(A P ) 阳性。这与我们所做的 h E S C s 或 h E C C s培养不同,它们的集落形态具有较大的预见性(见 图 5.3)。为了解决这个问题,我们通常在原代培养时及传代培养时使用多孔板,这样可以随时牺牲一些孔用于鉴定生殖细胞评价它们的生长,而不会搅乱大部分培养物的生长。同样,在传代时重悬细胞的样品也可取出用于附加的特性分析(见 5. 4.2 节)。这些步骤已经能够使我们很快地预测出哪些培养物应该采取措施,付出努力。在 最 初 2 周 内(通常是在第一次传代时),我们要评价培养物的生长特性、形 态 ,以及最关键的指标:是否含有碱性磷酸酶活性的细胞(见方案 5. 7)。 根据这些标准,培养物可以分为两种类型: 「pp」(弱增殖型)或 「V p」(强增殖型),我 们 将 「V P 」 细 胞 作 为 h E G C 状态的特征,并且在先前已报道,大约1 5 % 的原代培养物经过此步骤被证实具有衍生效力 [丁 urnp en n y et a L , 2003] 。

弱 增 殖 型 培 养 物 —「 P P 」
已证明这些培养物中只含有有限的生殖细胞, A P 染色显示只有个别细胞或很小一堆细胞是阳性,集 落 形 成 率 很 低(图 5.4)。用固定的细胞进行多能标记物的免疫细胞化学染色,也得到类似的结果。有意思的是,这些细胞可存活 5 0 天或更长时间,尽管持续添加各种因子(如 F G F -2)、试用不同组合的培养基配方以及各种有利于培养物的表面物质,但要使其转变为增殖型非常闲难。
强增殖型培养物—— 「V P 」
这些培养物形成各种形态的多样化集落或增殖性「迁移样,,细胞网络,它们生长在休止期的饲养细胞层上。 A P 强阳性的细胞占很高比例(大 于 9 0 % ) ( 见 图 5. 4)。在传代过程中,集落生长和网络增殖持续存在, A P 表达以及多能细胞的其他标志物(见方案 5. 7、 5 . 8 ) 的免疫反应活性也一直保持。与单个集落相比, V P 培养物中的网络细胞与体内迁移型 P G C s 的增殖能力惊人的相似。

如 果 V P 状态提示处于 P G C 向 E G C 的转变阶段,那与此相反, p p 培养物则表明未能进人这种状态。由 于 P P 细胞始终存在,因此这些发现便说明,细胞的存活以及支持它的培养条件对于 E G C 细胞的不很明确的「转变」(conversi 〇 n ) 或 「衍生,,(derivation) 并不起什么作用。到目前为止,对于决定 h E G C s 转化的因子还知之甚少。
2.人 生 殖 细 胞 培 养 物 的 特 性 分 析
培养过程中对人生殖细胞的特性分析可取对照材料同时进行,对照材料可用来源于性腺初始材料的両定的组织切片或 R N A 提取物,也 可 用 h E S C s 或 h E C C s 培养物。我们通过检测几个关键性的标志物,例 如 O C T s 、 S S E A s 以 及 h T E R T , 就 可 以 确 认 V P培养物中 h E G C s 的自我更新性。同样,这种基因表达谱的缺失伴随着分化标记物的出现 ,通过采集转录物和蛋白就可以鉴别来自外胚层、内胚层、中胚层的细胞谱系。这些鉴定方法可以满足在体外进行多能性鉴定的要求,也已经被所有从事 h E G C S 培养的研究 小 组 所 采 纳 [Shamblott et al., 1998; T u r n p e n n y et al., 2003; Liu et al., 2004;Park et al., 2004]。
碱 性 磷 酸 酶 活 性 染 色
检测碱性磷酸酶活性是监测人生殖腺培养物中生殖细胞谱系的一种可靠、易行、快速的手段。除了方案 7 中所特别列出的试剂之外,不同的商品化试剂都可使用。
方 案 7 生 殖 细 胞 培 养 物 的 固 定 与 碱 性 磷 酸 酶 染 色
试剂与材料
非无菌材料
□ PBSA
□ 多 聚 甲 醛(PFA), 4 % ,
□ 乙 醇 : 50%, 70%, 1 0 0 % , V/V
□ 测 定 缓 冲 液(见 5. 2. 7 节)
□ 氣 化 硝 基 四 氣 哩 蓝(Nitro-blue tetrazolium chloride, NBT), 100 mg/ml
□ 5-溴-4-氯-3’吲哚磷酸 p-对 甲 苯 胺(BCIP), 50 mg/ml
□ Aquamount
□去离子水
步骤
(a) 从培养器皿中吸去培养基,用 P B S A 轻轻清洗贴壁细胞。
(b) 吸 去 PB SA ,加入 用 P B S A 配 制 的 4 % P F A , 固定 3 min。
(c) 吸去固定液,再 用 P B SA 洗 。如果样品要储存起来,就 按 步 骤(d) 和(e) 操作 。如果要马上继续操作,就要用检测缓冲液短暂地平衡—下 ,而 后 直 接 按 步 骤(g)操作 。
(d) 去 除 P B SA , 通过不断增加乙醇的浓度使细胞脱水: 5 0 % 、 7 0 % 、 1 0 0 % , 每一步 2 min。
(e) 使培养器皿和固定的细胞在室温下干燥,而后储存于 4℃。
(f) 在培养物的表面加上检测缓冲液孵育 2 min,使细胞恢复水分。
(g) 吸去检测缓冲液,加入含有 4. 5 Mg/ml N B T 和 B C IP 的显色底物,加人的量为可覆盖细胞表面。
(h) 室温孵育 2 h, 避光。
(i) 如果是阳性,颜色反应肉眼可见,用去离子水洗细胞, 5 min。加一些封片剂(如 Aquamount) 用玻璃盖玻片封片。
(j) 用显微镜观察细胞。
免疫细胞化学分析
除了检测 A P 活性,免疫细胞化学(IC C) 也可用于鉴别多能干细胞标志物。许多生物技术公司出售大量抗体用于干细胞研究,我们常用的一些抗体列于表 5.1 。检测可用荧光,也可用亮视野显微镜观察可见的颜色沉淀反应。采用荧光 IC C , 要求使用玻片观察,而不能使用塑料的组织培养器皿,一 种简易的方法是在进行培养时将培养物接在包被有纤连蛋白的玻片上(方案 5.4)。

方 案 8 固 定 后 生 殖 细 胞 培 养 物 的 免 疫 细 胞 化 学 分 析
试剂与材料
非无菌材料
□ PBSA
□固定液,如: P B S A 配制的 4 % P F A ,或水配制的 40% (V /V ) 甲醇、 40%(V/ V ) 丙酮
□胰蛋白酶, 0.25%, lmmol/L E D T A , 溶于 PBSA
□一抗(见表 5.1)
□用生物素或荧光素标记的、针对一抗的二抗
□ 梓 檬酸钠(pH6. 0), 10 mmol/L 或 1 % (W V ) Triton X-100
□甲苯胺蓝(Tokiidine Blue)
□ DAPI
步骤
(a) 吸去培养基,用 P B S A 轻轻清洗细胞。
(b) 加人固定液(根据实验所用的一抗来选择不同的同定液)同定 3min。
(c) 用 P B S A 轻轻清洗细胞,同方案 5.7,细胞可用乙醇脱水而后储存起来,或直接进行 ICC [ 步 骤(d)]。如果是脱水后的细胞,在 步 骤(d) 后 必 须 用 Pb s a 处理5 min 以恢复水分。
(d) 在集落周围或在感兴趣的区域用石蜡画一个圈可以阻止液体的流动,商品化的蜡笔或指甲油也是可用的。
(e) 可渗透性处理取决于一抗的需要和组织培养表面的性质,如果使用的是玻片,可将其浸泡在沸腾的柠檬酸钠溶液中,但如果使用的是塑料培养器皿就不合适,这种情况可将样品用 1 % Triton X-IOO 处 理 20 min。根据我们的经验(可能是),使 用 表 5.1所列的各种转录因子的抗体,就将样品在沸腾的柠檬酸钠溶液中处理大约 5 min 是有好处的,使用其他抗体则不需要特别的「暴露」处理。
(f) 吸去增加通透性的溶液,用 P B S A 洗细胞。
(g) 吸 去 P B S A , 采 用 标 准 的 ICC 操作程序或抗体供应商提供的操作程序进行操作。
(h) 使用何种复染试剂显示细胞核,取决于采用亮视野 ICC 或是采用荧光 ICC, 前者使用甲苯胺蓝,后者使用 D A P I 。 同样,使用何种封片剂,取决于使用的是玻片还是塑料器皿.
培 养 物 的 R T -P C R 分析
对人生殖细胞培养物进行鉴别分析时, R T -P C R 是对免疫细胞化学分析的一个有力的辅助。我们将细胞样品常规储存于 Qiagen ’s 「RNA Later」, 利用常用的商业试剂提取 总 RNA 用 于 c D N A 合 成 及 P C R 。
人 生 殖 细 胞 培 养 物 的 核 型 分 析
研究人干细胞的强大动力来自于将来在疾病治疗方面具有巨大的潜力,这也使得干细胞的染色体稳定性非常重要。研究中期染色体的结构可以了解染色体结构直至数个兆碱基的变化,对于有经验的细胞遗传学家来说,如果结合 G i e m s a 染色、特 征 性 的 G -带图谱,可以得到更多染色体完整性方面的信息。从 h E S C 培养物已经得到多张图谱,显示染色体断裂、不 稳 定 的 髙 亮 度 区 域 [D r a p e r e t a l] , h E S C 比 h E G C 维持时间长,传代次数高许多,到目前为止还没有 h E G C 在这方面的报道,这可能是由于维持这些培养物在经受冻-溶之后仍然存活是件闲难的事,不能达到足够多的传代次数。
方 案 9 用 生 殖细胞培养物制备中期分裂相
试剂与材料
无菌材料
□ 秋 水 仙 胺(K a r y o M A X )
□ 胰 蛋 白 酶 , 0 . 2 5 % , E D T A , l m m o l /L , 溶于 P B S A
非无菌材料
□ 低 渗 溶 液(见 5. 2. 6 节)
□ 固 定 液 :甲 醇 :冰醋酸为 3 : I (V /V )
□ D A P I : 4』,6_一 脉基-2-苯基卩引噪, 5ug/ml
□玻片
特殊的仪器设备
□荧光显微镜
步骤
(a) 使 V P 培养物生长,长满一个 75c m 2 培养瓶或相当于这个量的其他器皿,在进行 步 骤(b ) 的前一天更换新的培养基。
(b ) 加 人 1 0 ul 秋 水 仙 胺(每 l 〇 m l 培养基),孵 育 I5〜20 m in。
(c) 用胰蛋白酶消化使细胞脱落,离心收集细胞,按照方案 5.6 操作。
(d ) 加几滴低渗溶液小心悬浮沉淀的细胞,用 塑 料 的 P asteur 吸 管 轻 轻 加 人 lml,继 续 轻 轻 悬 浮 细 胞 ,最 终 加 至 体 积 约 8m l ,轻 轻 地 反 复 混 匀 细 胞 ,置 37°C 孵育15〜20min
(e) 慢慢地逐滴加人 0.5m l 固定液,沿着试管壁滴加,避免损伤这些易破的细胞上下吹打 2 0 次,还是沿着试管壁。加入更多的同定液至总体积 l0 m l, 反复吹打产生气泡。
(f) 250 g 离心 5m i n 。
(g) 用 5m l 的固定液重悬细胞, 4°C 放 置 至 少 30m m 。如果需要,细胞可在这种状态下存放几天。
(h ) 250 g 离 心 5m i n , 用 2m l 固定液重悬细胞。
(i) 将未处理、未包被过的玻片浸泡在固定液中 30m i n , 用纸巾擦于玻片
(j) 以固定液预湿玻片,用玻璃吸管将细胞与固定液混合,在准备好的玻片上滴几滴 ,将玻片倾斜使液体流下来,片子在空气中干燥 , 剩余的细胞悬液可储存于一 20°C 。
(k) 在玻片上加一滴含有 D A P I 染料的封片剂,放一块玻璃盖玻片,在盖玻片的边缘用指甲油封闭,置荧光显微镜下观察。 D A P I 与 D N A 结合时在波长 460n m 发光。
(l) 染好的片子可在 4°C 避光储存,步 骤(j) 制备出的干燥、未染色的片子可在室温存放大约两周,也可将片子放在一个密封的有干燥剂的盒子中,保存于一 20°C 。
但是,如果实验推迟,最 好 还 是 用 步 骤(j) 得到的细胞悬液制备新的片子,不要依赖于长期储存在一 20°C 的片子。
五、人 生 殖 细 胞 培 养 物 的 分 化
1. 体 外 实 验 评 价 多 能 性
我们的实验已经证实,尽管有严格的影响去向的维持条件, V P 生殖细胞 / h E G C s在培养过程中仍具有明显的自发分化倾向。大部分报道过人生殖细胞培养的研究小组也间 接 提 到 这 ® 困 难 [ T u r n p e n n y et al., 2003; Liu et al., 2004; O n y a n g o et al., 2002]。然 而 ,在它们的增殖早期,未分化的标记物为阳性时, V P 培养物为在体外证实多能性提供了材料。我们的实验已经可以促进细胞的聚集,不论是采用汇合之后一直维持生长的方法,还是米用悬浮培养的方法。已有报道,不 加 L I F 、 F G F -2 和 forskolin,失去伺养层细胞的影响,能够促进分化,结果产生与来源于 h E S C 培 养 物 的 胚 胎 小 体(E B s )类 似 的 结 构(见 第 2 章)。与我们先前对培养物形态的解释相同,这 个 方 案 对 于 p p 培养物是行不通的,而对于 V P 生殖细胞培养物,则很容易产生多样的、清 楚 的 E B 样结构(g c E B s ,「gc」代表起源于生殖细胞)。然而,与 E S C 分化不同的是,没有观察到自发性的收缩,这与发生中胚层分化产生心肌细胞的倾向性很小是一致的。但是我们和其他研允小组都已经观察到神经分化的倾向,证 据 是 神 经 突 起 向 外 生 长 [Turnpennyetal., 2005]。
g c E B s —旦形成,就不需要在有利分化的条件下培养 [Shamblott etal., 2001],例如不需要在 9 6 孔板中加入各种分化生长因子。在平底的组织培养塑料器皿中 , gcEBs趋向于附着,细胞向外生长。在 未 处 理 的 圆 底 9 6 孔板中,可 维 持 不 附 着 的 gcE B s 结构 ,可通过免疫组织化学以及 R T -P C R 进行特性分析。 A P 活性进行性、持久性地丧失可以作为多能性逐渐下降的证据:对早期培养的 g c E B s (小于 2 天)进 行 A P 染色 ,可以看到未分化细胞类型的聚集,当 gcEBs 「成熟,,时 ,这种现象就减少了。
方 案 10 胚 胎 生 殖细 胞的 体 外 促 进 分 化
试剂与材料
无菌材料
□ 胰 蛋 白 酶 , 0. 25%, lmmol/L E D T A ,溶于 PBSA
□ PBSA
□ 氯 化 钙(CaCl2), lm o l/L ,用无菌超纯水配制
□ 明 胶 包 被 的 培 养 器 皿(见 方 案 5.4)
□ 培 养 皿 ,非组织培养级别
□ 细 胞 培 养 器 皿(直 径 6 或 3. 5c m 的培养皿或 24、 12、 6 孔板)
步骤
(a) 重 悬 来 自 V P 培养物的细胞,按 传 代 步 骤 进 行(见 方 案 5. 6),但接种于不含LIF、 FGF-2、 forskolin 的 GCM 中。
(b) 下列方法都可促进细胞的聚集:
程 序 1
(i) 加入CaCl2 至终浓度 4. 5m m o l /L 。
(ii) 将细胞悬液转移至一个未处理的无菌培养皿中。
(iii) 培养几天使细胞聚集,每两天部分更换培养基。
程 序 2
(i) 将细胞悬液转移至明胶包被的组织培养器皿中(方 案 5. 4)
(ii) 使培养物生长至汇合之后,每两天更换一次培养基。
(c) 收集发育的 g c E B s 放在未处理的圆底 9 6 孔板中继续单独培养。
(d ) 每两天更换一次培养。我们已经得到了维持 2〜2 1 天 的 g c E B s 培养物。
由 于 g c E B s 很 小(直径大约 1〜 3m m ),所以很难取,为了易于进行免疫组织 化 学分析鉴定其特性,可 将 g c E B s 包埋在一滴琼脂糖中,而后再进行石蜡包埋、切 片 、展片 ,用于标准的免疫组织化学研究。
方 案 11 生殖细胞胚 胎 小 体 结 构 的 证 实
试剂与材料
非无菌材料
□ 低 熔 点(L M P ) 琼脂糖
□ P B S A
□ 固 定 液 : P F A , 4 % (W /V ),或 甲 醇 :冰醋酸为 3 : 1
□热块
□ 乙 醇 , 70%, 80%, 90%, 100% (V /V ) ,用去离子水配制
□氯仿
□石蜡
□真空千燥箱
步骤
(a) 用 P B S A 溶 解 L M P 琼 脂 糖 于 试 管 中 , 1.5% (W /V ) , 将 试 管 放 在 3 7℃水浴中。
(b ) 将培养皿放在 5 〇° C 热块上,在培养皿内滴一小滴溶解的琼脂糖 (防止琼脂糖凝固)。
(c) 从培养物中取出单个 g c E B s , 用温 的 P B S A 冲诜。
(d ) 用吸管小心地将 g c E B s 置于琼脂糖滴中,将培养皿从热块上移开使其冷却。
(e) 将凝固的琼脂糖-g c E B s 浸 泡 于 同 定 液 中 (两种固定液任选),不要超过 2 h。
(f) 用梯度酒精脱水: 70%’ 8 0 % 、 9 0 % 、 1 0 0 % ,每级浓度放置 2 h 。
(g) 用 H 氯甲烷浸泡 2 h 以置换乙醇。
来源:丁香实验