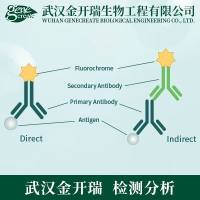
亲和层析实验:常规方法
最新修订时间:
材料与仪器
步骤
一、亲和介质的选择
亲和纯化的成功取决于是否选择了合适的固相载体和配基。理想的亲和介质 (如吸附配基的固相载体)应该具备孔隙大、理化性质高度稳定的特征。亲和介质可以选择性的捕获相应耙标,既保证较弱的非特异性吸附,又可以在整个过程中维持良好的流动特征。
优选介质应具备便宜、易获取和使用简便的特点。亲和介质可以是商品化的, 或通过适当的化学作用将配基吸附在固相载体上(详见本章第4节)。下文将详细讨论如何选择合适的亲和介质(GEHealthcare,2007;GustavssonandLarsson,2006;Zachariou,2007), 并对一些需要重点考虑的因素进行总结。
1.固相载体材料的基本特征
介质颗粒及孔隙应大小一致,且具有良好的流动性能。介质的表面积与孔隙呈负相关,这直接影响固定化配基数量,继而影响载量。孔隙与排阻限制相关,即一定尺寸范围或大小(分子质量)的蛋白质不能进入孔隙。大孔不受排阻限制作用的影响,允许大分子无阻碍地接近固定化配基,但会降低表面积和配基密度,进而降低纯化效率。根据Ren-kin方程(Renkin,1954),孔隙的大小应该至少达到一个生物分子平均大小的5倍以上,才能更容易接近固定化配基。假设蛋白质平均大小为60A, 孔隙的大小应至少为 300人或更高。大多数常用载体都会满足这一要求(表 26.1)。交联可以增加一些软凝胶介质的机械稳定性,但会减少孔隙率(孔体积),进而降低连接配基数量和结合能力。在大多数情况下,应具体问题具体分析,综合考虑孔隙和表面积,以达到最佳应用效果。

此外,粒子的直径和粒度分布也是需要重点考虑的因素。理论上,较小颗粒更利于外部流动相和粒子内部间更快的物质转移, 流速高且保持高效的亲和捕获。但是会导致更高的流动阻力,发生粒子崩裂的概率更高,如对颗粒和样品中的变性蛋白质等污染物的敏感性增加导致高负压。很大程度上粒度的选择取决于分离目的和方法。10颗粒最适合用于 HPLC分离,400颗粒适合于制备样品。为避免较小颗粒填充空隙体积并限制流速,粒度分布应尽可能均一。
2.选择性
亲和介质的一个主要特点是其选择性。复杂样品中蛋白质的选择是特异性的,这是由偶联在介质上的特异性配基决定的, 其他组分与配基的结合作用是惰性的。由于通常用于离子强度低的溶液,所以支持物应具有亲水性并带有一定电荷, 但这些电荷也会导致负面的相互作用,即离子相互作用。很多商品化固相载体都可满足这些要求, 有的是其天然结构,有的表面包被合适的材料。常见载体(如球状琼脂糖和纤维素)都可以从供应商处购买,如GEHealthcare的琼脂糖凝胶(S印harose)、Bio-Rad的Affigel(表 26.1)。非特异性选择由固相载体自身特性决定,如聚苯乙烯珠的疏水性、二氧化硅表面的负电荷。
用于结合特殊配基时,应对介质进行修饰,此时也会导致非特异性吸附。针对这些情况,应根据靶标的特征精心设计、筛选并优化化学吸附作用、配基、配基和介质间隔物的选择性和效能, 同时降低非特异性结合。
3.稳定性
使用过程中,亲和介质的理化性质必须稳定,这样载体材料本身以及吸附的配基才不会与所用溶剂发生反应,样品中可能存在的酶和微生物也不会使其被降解或破坏。通常制造商会提供商品化亲和介质的化学相容性,应将其作为成功制订纯化程序的指导原则。
交联琼脂糖通常可以承受宽pH范围(如pH3~12)、大多数水溶剂 (包括变性剂)、有机溶剂、修饰剂和酶的作用。而如玻璃和二氧化硅等材料在碱性条件下会水解而不稳定,因此, 通常在吸附配基前需要在这些材料表面进行涂层。介质也应该能承受物理作用力 (如压力, 尤其是装柱时)并在纯化过程中保持不变。高压能够压缩介质, 使其崩裂。与较坚固的载体,如二氧化硅、聚苯乙烯和其他高度交联材料相比,琼脂糖珠及其他软凝胶介质更容易受到压力影响。
整体柱是孔隙大、非颗粒型的单一介质,可以用许多不同的材料制造,如琼脂糖凝胶、二氧化硅、GMA/EDMA、晶胶(cryogel)(MallikandHage,2006;Plievaaetal.,2009)。
整体柱除具有亲和载体很多必备的特性外,还有以下特点: 流穿孔隙大、没有无效体积、形成对流而非扩散以及髙流速缩短运行时程,并因此得到广泛应用。此外,在柱层析过程中,介质不会被压缩,压力塌陷较少,可承受较宽的 pH范围和剧烈的化学作用。但与传统介质相比,整体柱也具有局限性,如载量低,每种整体柱的亲和载体均需要特殊的制备程序,而且目前可用的亲和形式有限等(MallikandHage,2006)。
4.磁性亲和珠
通过在每个步骤中亲和珠的迅速再生(如结合、流穿、洗脱),磁性分离可显著缩短纯化过程,而且与传统的柱洗脱相比可减少样品的稀释倍数。黏性材料会堵塞层析柱, 可用该方法。磁性无需样品预处理(如离心或过滤)除去不溶物和微粒等物质,因此可以简化纯化过程。将磁性分离应用于高通量分析, 可以大大缩短纯化过程(Saiyedetal.,2003)。
这需要将其小型化,并且可以进行多条件平行筛选,如筛选适合蛋白质表达的生长条件和纯化用缓冲液。
顺磁颗粒(paramagneticparticle)存在修饰和不修饰两种形式。修饰通常采用亲和配基 (如链霉素、GSH.proteinA等),或者偶联特异性识别的聚合物,如单克隆抗体和多克隆抗体(Konerackaetal.,2006)。除用于目标蛋白质纯化, 也用于固定,继而作为诱饵,从一个复杂的生物混合物中提取与其相互作用的分子。详见第16章。
二、配基的选择
选择合适的配基,需要对配基和靶分子之间的天然相互作用有一定的认知及理解。
靶分子与配基的相互作用必须是特异性结合,并且在不同的结合和洗脱条件下均应该稳定。此外,制订亲和纯化的方案时,需着重考虑能否购买到商品化配基,还是需要从头研制配基和介质。后者的成功在很大程度上取决于对蛋白质结构和相互作用特性的已有认识,需要采用分子模建、化学合成和有机偶联联合以及对选择性结合的分析。事实证明,设计一个新型配基、开发合适的偶联化学作用和介质的时间和精力过于冗长和昂贵,因此这种情况下使用非亲和纯化技术可能是一个更好的选择,如离子交换和疏水相互作用。
1.设计和选择配基的一般注意事项
在开发一个新的亲和纯化材料时, 配基和靶分子之间的亲和力是最重要的注意事项。
低亲和力会降低结合效率, 导致回收率下降。亲和力过高,苛刻的洗脱条件会导致目标蛋白质洗脱效率低或使其灭活,进而降低回收率。一般来说,亲和常量为 IO6~IO8mol-1 时, 可用于亲和纯化。与目标蛋白质结合的亲和配基,在与亲和介质连接前最好先进行评估。要注意的是固定后配基的亲和力可能与在溶液中的亲和力不同,某些情况下,甚至可能改变特异性。
共价偶联是将配基吸附于介质的首选方法,可以降低在纯化过程中滤去配基的风险。
然而,在没有活性基团存在的情况下也可以使用非共价吸附策略,或是用于降低配基变性的风险,如非特异性吸附、生物特异性的相互作用(生物素-链霉素)、包封(entrapment)及最近开发的分子印迹(Alexanderetal.,2006)。详情请参阅本章第4节。
配基与靶标之间结合能力的降低,除亲和力弱这一因素外,也可能是因为基质或其他配基导致的空间位阻引起的。配基和介质之间间隔物的介入能够降低介质造成的空间位阻(Hageetal.,2006)。设计间隔臂(spacerarm)时,应该考虑其长度和疏水性两方面,因为可以通过增强亲水性而减少配基与靶标外其他分子的非特异性相互作用。间隔长度的优化也很重要,间隔太短也许不能缓解介质的空间位阻效应,间隔太长则可能会促进非特异性的相互作用, 或者可能会形成自身折叠从而限制特异性的相互作用。表面的配基密度也要进行优化。非常高的配基密度可能产生反作用, 造成结合能力丧失,原因可能是结合位点靠的太近形成空间位阻,或是强结合力限制洗脱效率(Hageetal」2006)o其他因素也可能影响最佳配基的选择,如能否消毒、配基的稳定性、适当的储存条件和价格等。
2.固定化配基的特征
亲和树脂是否具备在重复应用中保持性能相似的能力是判断其实用性的—个重要因素。因此,确定最佳反应条件以保证性能一致显得十分重要,包括优化合成所需的配基数量。确定合成中所需最佳配基量可以防止配基过多造成浪费, 进而降低成本。
对于共价连接,一般需要分析介质可连接的配基数量,并确定偶联条件如何影响固定配基的数量。确定配基密度的一个简单方法, 是分析反应后剩余的配基数量。偶联完成后,用初始的配基总量减去剩余的配基数量。根据配基的性质,应采用不同的检测方法,如分光光度法、BCA法(检测蛋白质)、Ellman,s埃尔曼试剂(检测巯基)、荧光检测或其他检测方法(Guilbault,1988;Langone,1982)。
某些情况下,如通过氨基酸分析或元素分析, 可以直接检测载体上的配基,但是这会破坏材料,因此只适合少量检测。结合能力评估可以间接评价固定化配基, 使亲和介质处于纯化所需条件下,评估保留在介质上的靶分子数量。这种方法与亲和介质的性能直接相关,因此可能是固定化配基最有意义的检测形式。最大载量需在平衡状态下评价,通常以缓慢的流速或以直接混合的结合模式进行。注意:由于动态结合受到流速、介质孔隙内质量转移以及亲和常量的影响,因此动态结合能力可能与最佳结合能力不同。
3.运载特定配基的亲和介质
近年来,我们见证了针对不同靶分子的亲和配基以及商品化特异性介质的迅猛发展。
常用商品化配基的概述见表 26.2, 但并未涵盖所有可购买的配基。现有大多数可购买的亲和介质连接的配基通常称为「组特异性配基」(groupspecificligand), 表现为对一组结构或功能相似的蛋白质形成亲和连接,可以用于纯化具有类似功能的不同目标蛋白质。在下面的章节中,我们描述一些亲和介质常用配基。


4.免疫球蛋白结合蛋白质
免疫球蛋白的恒定区(Fe)与ProteinA 或 ProteinG之间可以结合,以此为基础的抗体纯化是亲和纯化中最有效并且常用的方法之一。ProteinA来源于金黄色葡萄球菌,ProteinG来源于链球菌。两者均为细菌相关蛋白,可以与IgG类抗体结合—-这些抗体可以为不同亚型, 也可以来源于不同有机体。目前有很多关于 ProteinA和ProteinG亲和力差异的详细说明,如供应商提供的商品化产品说明(Gussetal.,1986;Hageetal.,2006)。此外,最近ProteinB和ProteinL 作为免疫球蛋白结合蛋白应用广泛。proteinB是一类A链球菌的表面蛋白,可以结合某些人IgA型抗体,ProteinL[马格努斯消化链球菌(Pe辦OSZr印tococcwsmagmfs)]能够与kappa轻链相互作用, 且不影响抗体的抗原结合位点(Faulmannetal.,1991;Hermanson,1992)。因此ProteinL成为唯一的适合纯化缺乏Fc区抗体的蛋白质。
大多数情况下,在中性或接近中性 pH 的条件下抗体结合能力较好, 但不同样品的最适pH并不相同,这取决于具体使用的蛋白质。ProteinA在pH8.2时结合抗体的能力最强,ProteinL为pH5,ProteinG为pH7.5,但ProteinG也可以在pH7~7_5时使用。样品洗脱常为酸性 pH(2.5~3.0)环境, 为避免样品在低pH洗脱过程中变性或丧失生物活性,将其收集在中性或弱碱性缓冲液中。为防止低pH洗脱造成生物稳定性丧失, 需要探索盐梯度与pH梯度结合的洗脱方式。
5.凝集素
凝集素是一组多样化蛋白质,可以结合碳水化合物,具有高度的特异性。每一种凝集素都具有自己特异的使用方案。常用于从复杂的糖复合物中亲和纯化或浓缩碳水化合物基团,如多糖、糖脂和糖蛋白。还可以根据糖基化的特点,特异性分离不同的糖结构模式 (glycolform)。现在,凝集素不仅应用于纯化含糖分子,也可以用于质谱分析时浓缩糖蛋白亚类(Hirabayashi,2008)。详见第34章。
目前有超过1 00种的商品化凝集素,包括结合形式和单体形式,其中大部分是植物来源。来源于直生刀豆(CanawZiaensi/onm’s)的凝集素,即刀豆球蛋白A(ConA)是最常用的凝集素(Hermanson,1992), 其可以与『1>甘露糖、萄糖和JV-乙酰葡糖胺亲和结合。另外两个广泛使用的凝集素是麦胚凝集素(WGA) 和榴莲凝素(jacalin)。WGA 结合唾液酸和含有的N-乙酰-1>氨基葡萄糖残基的分子, 榴莲凝素结合 D-半乳糖基团。
通常在中性 pH、含糖条件下,将凝集素偶联到树脂上,这可以保护糖结合位点。靶分子通常也需要在中性 pH 条件下与凝集素结合。需要注意的是,有些凝集素需要二价金属离子的存在,这样更有利于靶分子结合,如 ConA 结合需要 Ca2+和 Mn2+。在洗脱缓冲液中加入过量的特异性糖分子进行洗脱,也可以进行梯度或分段洗脱。洗脱后,可通过透析或分子排阻的方法除去游离糖。
6.仿生配基
大部分的亲和层析配基是天然存在的,其优点在于具有高度选择性和强结合能力,但也存在某些缺点。这种配基稳定性低,需要进行纯化,使用过程中批间差异大,易被其他生物分子污染,对灭菌方法敏感,并且成本高。为了克服这些局限性,加速亲和层析在治疗性蛋白质纯化中的应用, 仿生型配基 (biomimetics)—合成亲和配基或变构的亲和配基已经成为研发重点,这是一种模仿天然生物配基结合方式和结构的物质。
活性纺织染料适用性强,呈现出多种竞争性生物分子具有的表面极性和空间构向性特征,可在水溶液中作为很多蛋白质的竞争性抑制剂、辅酶或效应分子,是应用最广泛的仿生配基之一 (MadoeryandMinchiotti,2006;Stellwagen,1”0)。包括应用最广泛的 CibacronBlueF3 G 染料在内,大多数仿生配基都含三嗉支架(triazinescaffold), 将其修饰后可以提高特异性,这也是仿生染料-配基概念的基础。在过去的几十年里,开发了充足的应用于蛋白质的广谱的,也即非特异性的纯化染料,包括针对血液蛋白(白蛋白)、还原酶、脱竣酶、糖酵解酶、核酸酶、水解酶、裂解酶、合成酶和转移酶等,并且将染料作为配基的亲和层析材料已经商品化 (表 26.2)(1^^0 11 抓~1 00 1^,1994;2002)。除了拓展商品化材料外,特制的仿生材料日显优越并逐渐普及。通过模拟靶蛋白中的肽段、天然生物识别基序或暴露表面的互补残基, 进而设计针对特异性靶蛋白的配基,这可通过设计合理的组合文库再经合成、筛选进行制备 (Ceciliaetal.,2005;Labrou,2003;Loweetal.,2001)。通过亲核取代反应在碱性条件下用载体表面的轻基取代染料中的氯,可以将含三嗪的染料固定在亲和介质 (如琼脂糖、葡聚糖和纤维素)上(Labrou,2000;LabrouandClonis,1994;Labrouetal.,1995)。
7.共价亲和层析
通常亲和层析是以靶分子与配基之间的可逆的相互作用为基础,但也可以通过共价相互作用分离特殊的 IE 分子(BlumbergandStrominger,1972;GEHealthcare,2007;Hage,2006) o 靶分子中的巯基与纯化介质上固定的活化巯基之间就是一种共价连接作用。可通过用 2-巯基乙醇、TCEP(乙基) 或二硫苏糖醇还原半胱氨酸的二硫键,洗脱结合的蛋白质。
最近研发了另一种以共价结合为基础的纯化,即特异性的氯化烷烃配基(chloroalkane) 和 HaloTag 蛋白之间的共价相互作用,如图 26.1 所示 (Losetal.,2008;Ohanaetal.,2009)。HaloTag 是一个 34kDa 单体蛋白融合标签,可以根据需要通过基因技术与蛋白质 C 端或 N 端融合。HaloTag 蛋白由细菌卤代掠经脱卤素酶 (haloalkanedehydroIase) 演变而来,首先对其活性位点进行修饰,以形成具有特异氯化烷烃配基的永久共价键。接着再通过突变增加蛋白质的稳定性, 并达到类似于生物素-链霉素的结合速率。在此基础上开发了一种基于 HaloTag 性质进行纯化的层析介质,即带有氯化烷烃配基的 HaloUnk 树脂。该层析介质对 HaloTag 融合蛋白的共价捕获结合速率快,克服了传统亲和纯化中平衡相关的局限性,能够实现对极低丰度靶蛋白的高效捕获。此外,这种层析介质可以接受多种严格的洗脱条件,不会损失结合的蛋白质。虽然共价联合有其优势,但在洗脱目标蛋白质方面也面临着挑战。由于 HaloTag 和氯化配基之间的共价键不可逆,因此不能利用传统方法从树脂上洗脱蛋白质。但是,目标蛋白质可以由特定的蛋白酶 (TEV) 释放, 其识别位点位于两个基团(HaloTag 和融合靶蛋白)之间。一旦被酶切,HaloTag 融合的蛋白质就会被释放,而 HaloTag 仍保持结合在树脂上,形成髙纯度的无标签蛋白(Urhetal.,2008)。

根据 HaloTag 自身的特性,除了前面描述的利用 HaloTag 纯化融合蛋白以外,还可以将 HaloTag 融合物固定作为亲和配基。类似于 ProteinG,可以用于纯化能与 Halo-Tag 融合蛋白特异性结合的抗体或其他蛋白质。该系统的优点在于,与其他共价固定技术不同,HaloTag 的固定化是通过活性位点进行单点吸附,因此可以定向。其他共价固定技术中蛋白质的结合是随机的,可能会导致多个吸附位点和定位不正确。单点定向吸附能力可增加系统的有效性和再生能力,HaloTag 融合物与介质共价结合, 可以改进特异性抗体纯化方法或 HaloTag 结合蛋白的分离方法。
三、化学吸附作用
一些传统介质,如脂糖、纤维素、二氧化硅、玻璃及合成的高分子支持物,其表面与亲和配基形成共价化学吸附,本节将简要回顾其中较常见的吸附形式。从策略上分析,化学吸附作用可以分为 3 个部分:①介质表面或树脂 (介质);②连接组分或树脂活性的成分 (间隔);③亲和配基。配基活性基团的类型和可用性限定了其如何与介质表面吸附。常见的基团是伯胺基、巯基和羧基。也可将配基修饰构建活性基团,如碳水化合物的氧化或正交活性基团的共价吸附,为配基的固定方式提供更多的选择。合成小分子的吸附策略趋于遵循与生物大分子相同的化学途径,但是在设计时往往也会有不同的考虑。
1.表面活化
制备共价亲和介质表面首先从表面活化开始。介质表面以两种方式接受配基,直接接受或通过活化连接物而接受配基,后者目的在于物理「隔离」配基与介质表面。表 26.3 总结了典型化学吸附,其中列出了已经构建的介质表面,并与用于吸附活化表面的配基主体进行对照。已经有多种已经商品化的预活化介质表面,所涉及的化学吸附类型多数可见表 26.3。如果配基表面已有合适的化学基团,那么其他要考虑的就可简化为明确最优的反应环境,这要权衡偶联反应发生的条件和影响配基稳定性的条件。大多数配基的偶联反应在水溶液中进行, 控制缓冲液的 pH,反应时间为 1~20 h, 反应温度介于 4°C 和室温之间。由于反应的异质性,浓度和混匀程度对确保反应物均一分布是非常重要的。尽可能保持反应的液相体积不超过树脂的 2 倍。配基浓度会因分子类型不同而变化, 但是对于蛋白质, 以 2.5~10 mg/mL 作为起始浓度是合适的。偶联反应可有较宽的 pH 和缓冲范围, 这取决于活化化学作用和配基活性(Hermanson,1992)。不同系统的表面活化效率各异,因此,封闭多余的表面反应基团以中和或降低非特异性反应是必要的。

2.配基吸附
对于多肽、蛋白质或核酸,通常采用的共价吸附是, 通过胺反应将配基上的氨基吸附在树脂表面。溴化氰活化表面与伯胺发生反应形成亚胺碳酸盐是最常见的胺反应吸附。
最典型的伯胺是赖氨酸侧链(Hermanson,1992;PorathetaU1%7)(详见第 28 章)。这种活化形式的优点在于可以使用商业化的预活化树脂,与蛋白质的偶联效率几近 100%。
虽然过去一直普遍使用这种方法,但也存在许多缺点:①连接导致配基从树脂上脱落;②配基直接吸附到介质表面, 无间隔;③由于溴化氰具有毒性,需要增加安全防范。而且,可能需要通过交联限制这种固定方式存在的缺陷 (KorpelaandHinkkanen,1976;KowalandParsons,1980)。
酰胺键的共价吸附是一种替代溴化氰活化作用的方法,可以通过活化的羧基表面 (如羟基琥珀酯) 形成,或者用偶联试剂对羧基进行原位活化,如冲乙基 N-(3-二甲氨基) 碳二亚胺 (EDCKWilcheketal.,1984;1994)。另一种可选择的较稳定的方法是仲胺化连接。伯胺 (赖氨酸或 N 端) 和醛活化表面形成希夫碱 (Schiff 碱)中间体,后者经过还原烷基化形成仲胺。还原烷基化的吸附方法偶联条件温和,据报道与其他方法相比可以保留更多的酶活性,因此这种机制广泛应用于将酶固定于碳水化合物表面 (琼脂糖或纤维素)(Hermans o n,1992)~
胺反应连接也是小分子配基与介质表面吸附的常用方法。首要的是预先设计配基中用于吸附的胺基。很多可以用于胺固定的化学试剂也适用于硫氢基 (或硫醇基) 活化固定。在概念上, 巯基固定与胺基固定相同,但前者依赖于半胱氨酸与活性表面的反应。对于巯基特异性固定,两个最突出的策略是通过卤代乙烷 (碘或溴) 和马来酰亚胺活化介质表面 (Malliketal.,2007)。巯基连接反应是可逆的,这也是其优点。用还原剂如 DTT 或 TCEP 处理, 可去除表面的二硫键连接 (Brniaetal.,1993)。
可以通过前面介绍的方法将抗体或糖蛋白固定到表面,也可以采用修饰碳水化合物的方式,这种方法可能更具有定向性(Oatesetal.,1998;VijayendranandLeckband,2001)。通过碳水化合物固定,需要采用温和氧化物 (如髙碘酸盐) 使碳水化合物的糖残基发生成醛反应。氧化形成的醛用于将蛋白质或抗体固定至酰肼化表面。这种方法通常用于抗体、糖蛋白、糖聚合物和核糖核酸 (O’shannessyandWilchek,1 卯 0)。
在大多数情况下,采用前面讨论的活性基团中的一种进行配基吸附就足够了。但某些情况下,需要增加连接物与介质表面间隔的距离。一种方法是用间隔物对目的配基进行正交修饰,另一种活性集团会优先识别吸附在表面上的正交标签。这需要用合适的活性基团修饰表面和配基。目前常见的所谓「点击化学」(clickchemistry) 就是这种方法的具体体现,即铜 (I) 催化的叠氮末端炔烃化的 1,3 肩极环加成反应形成 1,2,3-三唑 (0^-dranetal.,2009;GauchetetaI.,2006)。这种方法的优点是,化学作用温和,具有独一无二的选择性,并且活性基团可以在配基和介质表面之间随意转换。由于反应本身需要催化,因此与常用的硫醇和胺标记后活性基团相比,反应基团本身更加稳定。
四、纯化方法
亲和纯化程序从适当处理样品和介质开始,接着是靶标的选择性结合 (捕获),清洗除去非特异性背景,最后洗脱结合靶标。亲和纯化的成功取决于一些值得注意的因素,包括树脂上配基的数量和配基的可用程度、相互作用的强度以及固定蛋白质的完整性等。通常优化结合和清洗条件是为了将靶标及固定配基之间的反应最大化。然后从根本上转换成减弱相互作用的条件, 释放靶标。建议进行小规模实验,以选择最佳的纯化条件。下面章节简要概括一些常见的应用问题和影响亲和纯化的原因。
1.样品制备
制备纯化样品时, 选择的条件应能保持目的靶标适宜倍数和功能。强烈建议除去不溶物、降低黏度,因为这些因素都可能堵塞层析柱, 降低流速,增加反压。
一些蛋白质在高浓度时有聚合倾向,导致表观分子质量增加,降低扩散速率,减少亲和介质的捕获。此时,为了降低聚合, 增强对蛋白质的捕获和回收能力, 需要将样品或细胞裂解液稀释至较大体积。但是,如果样品太稀, 结合率和捕捉效率会降低,特别是对于低亲和力的结合物。
2.结合和洗漆
结合效率与蛋白质-配基间相互作用的强度和动力学相关,受到相互作用的特性、应用靶标的浓度、固定配基量及结合流速影响。式 (26.1) 为结合过程的简化,假设摩尔比为 I:1 时,Ka 为关联平衡常数,[L] 为配基浓度,[T] 为靶蛋白浓度,[LT] 为复合物浓度。
Ka=[LT]/([L]X[T]), 也可以表示为九/々 dA 为二阶联合速率常数,取决于 L 和 T 两者的浓度,&表示一阶解离常数,不依赖于配基浓度。Ka 为总靶标与结合靶标的比值,Ka 越高,吸附率越高,结合效率越髙。通常情况下,介质上配基的浓度为 KT4~10_2m o l/L。
艮值为 IO4~IO6mol/L 时, 可以实现有效结合。

通常在环境压力下,使样品缓慢流过用亲和介质装填的层析柱,可将其亲和固定至固相载体。一般来说,较高流速会降低结合效率, 特别是在配基与蛋白质间相互作用较弱或层析柱中的物质转移速率很慢时。结合程序也可以以直接混合的形式进行,将树脂和样品持续混合。尤其在处理大体积样品时,通常直接混合可以节省时间,有效地促进靶标和固定配基间的接触。但是,直接混合也会增加非特异性结合。在纯化过程中,优化树脂用量是很好的解决方法。在结合过程中,多余的树脂会增加非特异性结合,而且树脂的再吸附性会降低 IE 标回收率,因此要优选使结合靶标达到饱和的树脂用量。除非在某些特殊情况下才需要降低靶标回收率。
接下来的程序是洗涤。通过清洗去除非特异性结合的蛋白质。例如,通过增加盐浓度 (0.1~0■5mol/L) 或改变 pH 降低离子相互作用; 通过降低盐浓度, 改变 pH, 或加人表面活性剂 (如 TritonX-00) 去除疏水相互作用。也可用少量的竞争物去除与配基结合较弱的污染物。为了最大程度去除杂质,最小限度损失靶标, 应慎重决定清洗缓冲液的体积 (如 5~10 个柱体积) 和流速。
3.洗脱
实质上,从树脂上洗脱结合靶标是结合的可逆过程。因此优化条件降低 Ka,即可削弱靶标和配基之间的相互作用。洗脱条件不应使靶蛋白质变性, 除非这些条件与下游程序兼容。
有两种不同类型的洗脱方法,即特异性洗脱和非特异性洗脱。特异性洗脱过程中, 介质或竞争配基或竞争靶标,通过这种形式攻击蛋白质-配基复合物,继而将靶蛋白释放至溶液中。用于洗脱的竞争介质的浓度和量 (体积) 依赖于其亲和力,这种亲和力与固定复合物的亲和力相关。与亲和力强的添加物相比,竞争介质的结合越弱越需要更高的浓度和更大的体积。对于弱的竞争介质,比配基高 10 倍是较好的浓度起点。特异性洗脱通常是温和的,更可能保留蛋白质的活性。这种方法的缺点在于,洗脱慢,洗脱峰宽,需要从回收的蛋白质中去除竞争介质。对于非特异性洗脱,应控制溶剂条件降低关联速率常量 [式 (26.1)],该常量应趋近于零,同时增加解离速率常量,进而削弱整体亲和力 (Ka), 导致复合物解离。根据配基与蛋白质之间的相互作用机制优化洗脱条件, 如增加盐的浓度、降低离子相互作用或通过改变 pH 来改变质子化/离子化状态,从而调节氢键强度、疏水相互作用及静电相互作用。从固定的 ProteinA 或 ProteinG 上洗脱抗体就是一个改变 pH 的例子。然而 ProteinA/ProteinG 与抗体的亲和力非常强 [Ka 为 lOVCmol/L)-1 左右)], 需要不同洗脱条件组合达到最大程度的抗体释放。通常, 亲和作用需要靶蛋白质正确地三维折叠,因此离液剂或影响蛋白质折叠的试剂可用于洗脱目标蛋白质,但是,必须注意保证耙标的正确折叠在洗脱后迅速恢复天然条件。当亲和力弱时,高浓度靶分子结合后,通过稀释以解离、洗脱复合物。这种方法即等度洗脱 (isocraticelution)。
来源:丁香实验