原理

材料与仪器
步骤
材料
![专用的材料 —60:40 聚丙婦腈/聚 氯 乙 浠 ( polyacrylonitrile/polyvin ylchloride, P A N /P V C ) 共聚 体半 渗 透 导 管 ( 内 径 2.6m m , 外 径 3.0m m , 管壁 小 孔 可 通 过 分 子 质 量50 k D a) 和 P A N /P V C 胶,均由 D r. P atrick A ebisch er 惠 赠 ( C en tre H ospitalier U niversitaire V a udois, Lausanne, Sw itzerlan d)。导管是用常规的旋转技术[详见 Cabasso (1980)和 A eb isc h e r等 (1991)]制成的,导管可通过D r. A e b is c h e r或在美国罗德岛的0)^:〇1:116— 611- tics (R h ode Island, U S A ) 获得 一半渗透P A N /P V C 共 聚物导管( 内径2.6m m ,夕卜径3.0m m ,管壁小孔可通过分 子质量 50k D a) 和 P A N / P V C 胶由 D r. P atrick A ebisch er 惠 赠 ( 见致谢) 一促增殖因子:重组的 heregulin p i (r H R G p i17 7- 24i IOnm oIZ L; G enentech, South S a n Francisco, C a lif., U S A ); 霍舌L毒 素 ( cholera to x in ; lOOng/m l; Sigm a, S t. L ouis, M O . U S A ); forskolin (1/im ol/L ; S ig m a) — M atrigel (C ollaborative R esearch, B edford, M a ss., U S A ) 一抗 S-100 抗 体 ( I :100; D akopatts, G lostrup, D en m ark); H oechst 焚 光 染 料 (5/xl, H oechst-33342; S igm a) 一神经元示踪剂 一逆行追踪: F ast B lue (Sigm a, S t. L ouis, M o . U S A ) —顺行追踪: P H A - L ( Phaseolus vulgaris leucoagglutin in; V e c to r L ab, Burlingam e, C a lif., U S A ) 一R D A (罗丹明-葡聚糖胺,葡聚糖胺,四甲基罗丹明;亦称 Fluoro R u b y; M olecular P robe, C a t. # I M 817) —B D A 生物素连接的葡聚糖胺 ( biotinylated dextran am in e; M olecular P robe, E ugen e, O re., U S A ) 一精密离子导入仪( T ran k in etics, C S3)](http://img.dxycdn.com/trademd/upload/userfiles/image/2016/07/B14685471486074scp2xzfs3png_small.jpg)
步骤
使用方法将分为三部分:
1.细胞移植物的构建:雪旺细胞的获得和体外增殖。
2.雪旺细胞准备、装载入导管,以及植入大鼠体内。
3.用解剖学方法证明轴突再生
一、细胞移植物的构建:雪旺细胞的获得和体外增殖
雪旺细胞培养较为复杂,本章节提供的实验方案仅为几种可行的方法之一。近来有报道显示不含血清培养更有利于雪旺细胞的体外增殖 (Lietal.1996)。然而值得指出的是我们在体内观察到的再生现象是通过本实验介绍的培养方法所取得的,体外条件的显著改变也许会影响移植到体内 的细胞功能。周围神经来源的雪旺细胞的纯化培养涉及下列几个关键步骤(图 13-6):
1.将神经解剖成若干神经束进而切成神经小块易于使培养液扩散入神经以维持其活力。
2.通过雪旺细胞纯化以提高神经小块中雪旺细胞/纤维母细胞(SC/FB) 比例。一系列将神经小段从旧培养皿转移到新培养皿的过程是达到纯化雪旺细胞目的的方法之一。
3.将神经小块酶解成单细胞悬液。
4 将细胞种植于适宜的培养基质以获得纯化的单层细胞。
5.雪旺细胞的扩增、纯化和传代。
6.获取高活力的细胞、减少细胞丢失。
7.移植前作细胞纯度鉴定。
1.从人或啮齿动物神经解劍分离成神经束,切成组织碎块,通过培养液护散以维持其存活
当使用人的神经时,应考虑到有感染的可能并做好预防措施。除了周围神经,马尾神经根也是获取雪旺细胞的极佳组织^在大动脉夹住 30 min 内收获神经,并于 RPMI(GIBCDLaboratories,GrandIslandN.Y.,USA)41C 保存,不超过 24 h。按照 Morrissey 等(1990) 方法,在层流式超净台中用解剖显微镜解剖每条神经或马尾神经根。神经用 Lieb 〇 Vitz’sL15 液(GIBCO) 洗涤 3 次,剥离神经外膜,分离神经束。L15 因其在空气中保持稳定的 pH 值(相对于 DMEM 而言)而被用作洗液。神经束被切成 2~3 mm 长的组织块,置于 IOOmm 塑料培养皿中,起始培养液的量要少从而形成表面张力使组织块贴壁,将培养皿置于 CQ2 培养箱中,保持空气湿度和 5%CO2 气体。每周换液 3 次。培养液组成:DMEM(Dulbecco’sModifiedEagle’sMedium,GIBC0),10% 胎牛血清(FCS;HycloneLaboratories,Logan,Utah,USA) 和青霉素(50U/ml)/链霉素(50fxg/ml)。有关在这一时期如何提高雪旺细胞/纤维母细胞比例可参考 Casellaetal.(1996)。
要点
要确保组织块接触培养皿底面以使纤维母细胞易于迁移出广如果培养液过多,则组织块漂浮于培养液中而不会贴壁。
系列转移—提高组织块中雪旺细胞/纤维母细胞比例神经组织块贴壁后,纤维母细胞从组织块内不断迁出,在组织块周围形成以纤维母细胞为主的单细胞层(一般需要 7~14d)。此时,将组织块转移至新的培养皿,并重复上述步骤。经过 3~5 次这样的转移,组织块内大量的纤维母细胞在迁出后随旧的培养皿而被丢弃,剩下的则是高纯度的雪旺细胞了_按照 Pleasure 等(1986) 实验方法将其酶解产生雪旺细胞。
2.神经组织块酶解形成单细胞悬液
将组织块集中,加入 l~2 ml 混合酶解液。该酶解液含有 1.25U/ml dispase(Boehringer Mannheim Biochemicals,Germany),0.05% 胶原酶(collagenase;WorthingtonBiochemicals,Freehold,N.J.,USA) 和含 15% 胎牛血清的 DMEM。组织块在酶解液中过夜,翌日早晨用细口玻璃吸管(火上烧制使顶端细窄)轻轻吹打直至将组织打碎解离出细胞。离心细胞并用含 10% 胎牛血清的 L15 洗涤 3 次,然后种植于 200 g/ml 多聚 L-赖氨酸(poly-L-lysine,PLL;Sigma,St.Louis,Mo.,USA) 或其他适宜的底物上。
要点
用细口玻璃吸管吸打组织时动作要轻柔,因为若吸打不当,可造成许多细胞损伤。另外,细胞数过少会使体外扩增的时间大大延长。
3.细胞种植以获得纯化的细胞单层
雪旺细胞可被种植于不同的底物:塑料、多聚 L-赖氨酸(PLL),胶原和层粘连蛋白(laminin)。一些底物在不同程度上支持细胞分裂(Casellaetal.1996;Lietal.1996)。底物的选择对人的雪旺细胞培养至关重要,因随着传代次数的增加,其附着能力也在下降。雪旺细胞在胶原上生长良好但分离较难,在 PLL 上不但生长良好而且用常规的胰酶消化较易将其分离。对于啮齿动物雪旺细胞培养而言,PLL 是种很好的选择。
要点
种植密度至关重要。密度过低,分离细胞内少量的纤维母细胞增殖较快而迅速占满培养皿。另外,低密度的雪旺细胞不太健康,可能是因为自分泌的因子太少。理想的密度应控制在 2XIO6 细胞/100 mm 培养皿。
4.细胞的增殖和进一步纯化
由于纤维母细胞在含血清培养液中易于增殖且迅速成为优势细胞,因此促雪旺细胞扩增乃为移植物准备之必要条件,所以需要采取一些特殊的步骤支持雪旺细胞增殖并抑制纤维母细胞。许多分子可以用于体外培养中提高雪旺细胞增殖速率。这些分子包括垂体提取物(含胶质细胞生长因子)、PDGF、Forskolin、霍乱毒素(Levietal.1995;Morrisseyetal.1995;Casellaetal.1996;Scarpinietal.1993;BungeandFernandez-Valle1995)。Forskolin 是一种腺苷酸环化酶的激活剂,能降低纤维母细胞的分裂并促进一些丝裂原的活性(Rutkowskietal.1995)^为获得增殖的人雪旺细胞,分离的细胞种植于 DMEM510%FCS 和三种丝裂原组合的混合液中,包括重组的 HeregulinBl(rHRG(31i77-24il 〇 nmol/L), 霍乱毒素;100ng/ml 及 Forskolinlp 1umol/L。有报道称无血清培养液能促进雪旺细胞分裂的同时抑制纤维母细胞分裂(Lietal.1996)。
一旦雪旺细胞生长成片,应用不含 Ca2+/Mg2+的 Hank’s 平衡盐溶液(HBSS;GIB-⑴)冲洗 2 次,然后在 0.05% 胰酶和〇. 〇 2%EDTA 的 HBSS 消化液内于 371:消化 5~lOmin,并轻轻摇晃将雪旺细胞从覆盖 PLL 的培养皿中洗脱下来。收集细胞并用含 10%FCS 的 L15 洗 2 次,然后种植于覆盖 PLL 的培养皿中,加入含 D-IO 的丝裂原混合液。人雪旺细胞的第二、三代细胞即可用于移植,而啮齿动物雪旺细胞可延后几代再使用。
要点
人雪旺细胞体外增殖有限:大约经过 5 次传代就会发生老化,停止分裂,且难以贴壁。同样的情况也会发生于啮齿动物,只是在它传代更久。如果使用限定的培养液上述现象则可能避免(Lietal.1996)。
雪旺细胞污染:我们从未成功地挽救过感染的雪旺细胞,因此一旦发现有感染,应立刻剔除被感染的培养皿。细菌和真菌感染都会发生。试图抢救受感染的培养细胞将会面临失去所有培养细胞的危险。严格遵守无菌操作,及时清洁超净台及培养箱会将污染的可能性降至最低。另外,我们还可以在培养液中加入青霉素和链霉素以预防污染。
5.获取高活力、低损伤的细胞
将细胞从培养底物上分离的条件较为苛刻(如酶解液浓度、消化时间、摇晃的轻柔度等),且不可逆地影响细胞的得率,从而会直接影响移植的成功与否。用台盼蓝染色检查细胞活率,活率应超过 90%。
要点
细胞损伤会导致胞内 DNA 释放,从而使细胞融合成片,妨碍细胞移植物的准备,; 此时用些低浓度的 DNA 酶(0.1%DNase,Sigma) 或许有助于细胞的分离。
6.移植前的细胞鉴定
解释细胞移植的结果需首先准确知晓移植物的组成成分。单在光学显微镜下评估并不可靠。可选用一些雪旺细胞特异的免疫标记物如孓 100 来鉴定雪旺细胞。下列方法能将雪旺细胞从纤维母细胞中区分出来。
人或裸鼠的雪旺细胞装载移植导管的同时,留一小部分种植到氨化胶原(ammoni_atedcollagen) 包被、用 Aclar 材料(AlliedFiberandPlastics,Pottsville,Pa.,USA) 自制的小培养皿中(Kleitmanetal.I”8X。翌日细胞作 S-IOO(1:100 稀释)的免疫染色,S-100-jk 一’种只表达于雪旺细胞、不表达于纤维母细胞(Scarpinietal.1986) 的抗原, 从而获得雪旺细胞的纯度。反应结束后,将 Aclar 小培养皿的边缘剪去,细胞种植面向下盖在滴有一滴 Citifluor 盖玻液(London,UK; 内加 5/JVIHoechst 染料)的载玻片上。Hoechst 染料在荧光显微镜下显示所有标记的细胞核。雪旺细胞的 S400 和 Hoechst 染色皆阳性;. 纤维母细胞(多极扁平状)的 Hoechst 染色显示阳性,但 S-100 染色阴性。雪旺细胞的纯度范围应在 90%~99%u
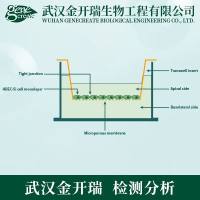
7.雪旺细胞装载入导管以及植入大鼠体内(图 13-6)
主要步骤:
(1).导管清洁。
(2).移植物装载入导管。
(3).移植。
(4).术后护理。
导管为细胞移植物的有机组合提供一个微环境。导管可有许多类型,它们的结构特点对移植结果影响很大(Aebischeretal.1988,1989,1990;Valentini1995)。导管至少应具有生物适应性和无毒性的特点。本研究中所用的导管是具有生物适应性的合成聚合体,导管内膜平滑并有许多一定规格孔径的小孔。这种导管原被大量用在动物周围神经系统研究中(Gurnardetal.1992;LevietaL1994,1997), 后被 Xu 首次应用于脊髓损伤研究中(XuetaL1995a)。使用 Matrigel 可使导管内的雪旺细胞均匀地弥散,有利于移植物成条索状并使其成为胞外基质分子如层粘连蛋白和胶原的来源。然而,只有 Matrigel 没有雪旺细胞的导管其支持周围神经系统再生轴突的能力低于含有生理盐水的导管(Valentinietal.1987)。
(1)导管清洗
在将 PAN/PVC 导管切割成 IOmm 长度之前,先将 6~8 cm 的导管进行清洁、灭菌 (Aebischeretal.1988)。用 0.lmol/L 盐酸、浓度梯度乙醇(95%,70% 和 50%) 和灭菌的生理盐水依次加压灌洗导管,灌洗时使用灌流泵可以观察到导管表面小孔中由于压力形成的水珠。
要点
导管的彻底清洗固然重要,但是如果压力过度(如灌流速度过快)导管内径会因扩张呵扭曲,内膜也可能被破坏。
(2)导管内移植物的形成

要点
这是个关键步骤。首先,所使用的所有实验材料包括塑料培养皿、吸管、细胞、培养液和 Matrigel 应放在冰上致冷。尤其是 Matrigel 必须缓慢融化至 4t:,不能突然加热;否则,它在与雪旺细胞混合前已成凝固状。其次,必须注意细胞/MatrigeI 混合液不能在层流式超净台中过度鼓风蒸发,否则细胞密度将被改变. 第三,Matrigel 易产生气泡,从而使移植物内细胞分布不均,影响轴突再生。依我们的经验,这是移植物成型不佳的最常见原因。最后,被混合的移植细胞在 Matrigel 凝结之前会在培养液内大量流失。为预防此事的发生,在将装入导管的细胞混合物放入培养液前,应将导管的两端封闭。我们选用 PAN/PVC 共聚体胶达此目的,也有人使用其他材料如纤维蛋白胶(fibringlue)。移植物置于含有丝裂原、青霉素(50U/ml)/链霉素(50 g/ml) 的 DMEM/10% 胎牛血清培养液中 371:孵育过夜。
移植物在移植前置于含血清的培养液中有助于避免撤去血清后细胞活力受到影响。(译者注:10% 胎牛血清培养液可引起宿主排异反应,置于过夜的培养液内实非必需。)
(3)植入(图 13-7)
所有大鼠实验均按美国国立卫生研究院实验动物照顾和使用条例进行。为防止将人雪旺细胞移植入鼠所弓丨起的免疫排斥,我们使用无胸腺的体重为 165~185 g 的雌性裸鼠 (HarlanHsd:RH-mu/mu;Harlan) 作为受体鼠-用氧气(0.9L/min)、一氧化二氮 (nitrousoxide;0.4L/min) 和三氟溴氯乙烧(halothane;1.5%) 混合气体麻醉大鼠。手术削,使用抗生素(cefazolin,15 mg/100 g 体重;EliLilly,Indianapolis,Ind.,USA) 肌注以防感染。所有手术皆在无菌条件下实施,大鼠背向上,用耳杆固定头部。

实施 T7-T10 的椎板切除术,纵向切开硬脊膜以显露出 T8-T11 段的脊髓。用新折断的剃刀刀刃作为解剖刀横断脊髓,取出 T9-T11 脊髓段。注意保持腹侧硬脊膜的完整,因其能支持移植物并减少断端脊髓的分离。可以暂时牵弓丨动物的尾巴以加宽两脊髓断端间的间隙,有助于导管植入。
由于脊髓远端的断端较软,所以最好在将近端脊髓插入导管之前,先将脊髓远端导入导管内约 1_。撤去尾部牵引后,由于脊髓两端间距离缩小,脊髓与移植物间交界面更理想,说明移植手术较成功。将两侧残留的硬脊膜拉上并覆盖于导管表面,用一片人工脑膜(Durafilm;CodmanSurlef,Randolph,Mass.,USA) 或桂胶膜片盖在导管和移植交界面上。人工脑膜的作用是在随后的示踪过程中易于接近导管以及灌注后识别移植物和邻近脊髓,然后逐层关闭肌肉和皮肤。
要点
麻醉:密切关注截瘫大鼠的麻醉深度和足够的肺换气量。动物的死亡率与手术过程密切相关,动物在外科手术进行时易于发生肺换气不足和呼吸暂停。脊髓变形及固定过程均可限制呼吸活动。有必要减少各种形式的牵拉以免影响呼吸。必要时可减轻麻醉深度。动物脊髓横断后体温调节功能会失常,因此我们使用具有持续热反馈调节的电热垫以保持手术动物体温恒定。使用吸入麻醉法以便调节麻醉深度。
手术技术:如果不是利用锐器横断脊髓,则脊髓断端会肿胀。结果,肿胀的脊髓断端被导管压缩后发生继发性损伤坏死。使用甲基强的松龙能降低脊髓残端缺血的发生,从而促进轴突再生入雪旺细胞装载的导管(Chenetal.1996)-脊髓背静脉和腹动脉都可能大量出血,只要用凝血酶浸润的明胶海绵(Upjohnetal.USA) 局部轻轻按压即可止血。注意在脊髓断端和移植物之间不能有血块形成。
脊髓残缺:我们经常注意到在脊髓横断和导管移植后发生术后脊柱变形现象。在某些情况下,驼背和脊柱侧凸足以破坏移植物,为防止此类事情的发生,我们依照有关步骤固定脊柱(图 13-7C;DeMedinaceliandWyatt1993;ChengandOlson1995)。这些步骤尽管延长了时间,增加了技术难度,但却十分有效。
(4)术后护理
移植一旦结束,立刻将大鼠放回笼子,并给予易于寻获的食物和水。皮下注射 5 mlRinger’s 乳酸盐溶液(KendallMcGawLab.,Irvine,Calif.,USA) 以补充失血。每天肌注 Cefazolin(15 mg/100 g)2 次以预防尿路感染直至膀胱恢复排尿功能。术后第 1 周每天帮助膀胱排空 3 次,以后数周每天 2 次直至膀胱恢复自动排尿功能。大鼠被隔离在有高效微粒空气过滤器的房间并能随意取用高压灭菌过的食物和水。
要点
脊髓横断的动物膀胱护理尤为重要,否则容易引起尿路感染、结石和膀胱破裂。一旦发生严重的尿路堵塞或膀胱破裂,可行手术造瘘以维持动物生命。
三、解剖学方法证明轴突再生
脊髓损伤的动物经移植后,其轴突再生可以通过几种解剖学方法加以证明(图 13-8)。我们依次选用:
1.光学显微镜(LM)。。
2.免疫组织化学染色(IHC)。
3.电子显微镜(EM)。
4.神经标记物的顺行、逆行追踪。

前三种方法较为成熟且应用广泛,此处不再另作叙述,只提供一些例子和我们在实验中遇到的一些难点(Xuetal.1995a,b,1997;ChenetaL19%;Guestetal.1997a,b,1998)
用 LM、IHC、EM 方法中,我们发现在导管内的再生移植物与正常周围神经和中枢传导束结构有所不同:
1.大部分轴突及其神经纤维束主要分布在移植物外周(图 13-9B,C)。
2.中枢神经轴突在雪旺细胞移植物内成束生长,但在脊髓-雪旺细胞移植物的交界面生长不规则(图 13-10B)。
3.中枢神经轴突在移植物内被雪旺细胞形成的外周髓鞘包裹。
要点
1.雪旺细胞/Matrigel 移植物易被损伤,甚至会在组织学的处理过程中丢失,尤其是在矢状冷冻切片和免疫染色时。因此』必须注意保存交界区域的组织以便对结果做出正确分析。为此,我们通常在切片前,参照 Oudega 等(1994) 法将导管、移植物和邻近脊髓用凝胶包埋。

2.移植物和宿主组织的交界面经常会被囊腔和瘢痕破坏。由于组织的不均一性以及仅有少量纤维穿过交界面长入宿主脊髓,检査所有切片尤其是矢状切片中再生的轴突至关重要。

神经解剖学示踪(图 13-8B,C, 图 13-11 和图 13-12)
我们采用下列方法做轴突示踪:
1.FastBlue、突光金标或其他英光标记法做逆行示踪。
2.PHA-L、RDA、BDA 做顺行示踪 9
HRP 被广泛应用于逆行和顺行示踪,已在周围神经移植部分有所叙述。
逆行示踪法
方法:详见一些参考文献(GerfenandSawchenko1984;Xuetal.1995a,b;Guestetal.1998) 。
导管是注射逆行示踪剂的最佳部位。在导管背部壁上切一个窗口可见其下之移植物。但此时仍难估计移植物-宿主交界面的准确位置,因为交界面仍被盖在未打开的导管之下(图 13-10A)。因此,我们在距脊髓的近端至少 3 mm 处向移植物注射追踪剂以减少因追踪剂弥散而造成近端轴突(译者注:即未长入移植物的轴突)的非特异性逆行标记。不同的追踪剂其弥散的特性也会有所不同(RichmondetaL1994)! 此外,适当的对照也是必要的。例如,在同组移植动物中,选几例在接受逆行追踪剂前先切断移植物的近端观察是否有示踪剂弥散现象。这在第一次用示踪剂的情况下尤为重要。
PAN/PVC 导管周围的瘢痕组织能防止示踪剂渗漏入蛛网膜下腔,同时,移植物上、下的蛛网膜下腔不与导管和移植物相通,因此脑脊液被示踪剂污染的可能性很小。
要点
移植物和脊髓在注射示踪剂的过程中易被损伤,尤其是动物在呼吸过程中或注射示踪剂过程中发生移动。为防止动物移动,注射部位上下之棘突可暂时固定在定位仪上。我们也使用 0.1% 利多卡因滴在脊髓表面作局麻。
逆行追踪的评估:可计算脑干和近端脊髓纵切或横切面上逆行标记的神经元的数目 (图 13-11B,C)。
顺行示踪
此项技术可追踪再生的轴突及其末梢,它使观察特定部位如宿主-移植物交界面的再生现象成为可能(Guest et al.1997a) 。
从大脑顺行标记:顺行示踪剂注射入大脑皮质较脊髓或移植物注射更具可重复性、用时短且技术简单。注射后大约需 12~14d 才足以使 RDA 和 BDA 从运动皮层顺行转运至脊髓胸段末梢(Guestetal.1997a,b;Xuetal.1997)。顺行标记皮质脊髓束的其他方法在 SchnellandSchwab1990,1993;LiandRaisman1994 中有详尽的描述。
从脊髓顺行标记向脊髓内注射示踪剂能标记灰质中固有神经元,或标记白质中的传导束(过路纤维)。有大量的脊髓内神经元(主要是脊髓固有神经元和运动神经元)再生长入雪旺细胞移植物(图 13-11A,图 13-12A,B;Xuetal.1995a;Guestetal.1997b)[译者注:运动神经元并未长入雪旺细胞移植物(Xuetal.1995a,1997)]。
加压注射法或离子导入法注入示踪剂皆可使用,注意按照逆行追踪一节描述的方法固定动物的脊柱。加压注射法是一种可靠的方法但会造成局部损伤,损伤的大小与注射的量、速度、示踪剂的毒性和注射过程中动物是否移动有关。离子导入法需要有精细的针头、较长的注射时间和特殊的设备,但能将创伤降到最小。为平衡标记纤维的量和示踪剂注射造成局部损伤,我们先用小剂量示踪剂加压注射后再用离子导入法(压力-离子导入;Guestetal.1997a,b), 大范围、小创伤的效果可在注射 RDA,BDA 或 PHA-L 时获得。
要点
在大鼠首侧胸段脊髓进行顺行固有神经纤维再生时在技术上较为困难,因为在 T4 或 T5 处有一条大静脉从颈胸脂肪垫进入硬膜外静脉系统,如该静脉受损,会发生大出血(DeMedinaceli1986)。


来源:丁香实验